一、销售人员
销售人员的资质
①全职;②高中以上学历;③无不良品行记录;④须经过药品相关法律、法规和专业知识培训并合格。
销售人员管理
包括销售人员信息管理、个人销售计划与总结管理、销售任务管理、知识技能管理。
销售人员的行为规范
①严格按照企业管理规定销售药品;②不得向个人和无药品经营许可证的单位销售药品;③不得以各种名义向医疗机构及工作人员、医务人员给予回扣、提成现金、有价证券和支付凭证等;④在投标过程中,不得以弄虚作假和不正当手段获得商业机会或商业利益;⑤不得向国家行政工作人员提供现金、有价证券和支付凭证等。
二、客商
企业建立经销商和对应联系人信息资料及产品销售资料,销售人员负责对客商的日常业务管理。
三、销售渠道
管理内容:监控药品出厂后通过各级环节的物流方向,及时掌握系统中各级经销商的销售库存情况;跟踪各经销商进货及回款;分配销售指标,核算各地区及销售人员的销售业绩。
四、销售合同
企业制定详细的产品价格管理体系,销售人员按相应销售的价格签订销售合同,企业结合企业管理规程实现订单与合同审批流程,结合财务数据进行信用额度的管控。
五、销售费用
销售费用管理包括:市场活动管理,计划任务分配,促销活动推行监控,销售预算管理,报销管理,费用分析。
六、产品发运
发运
企业将产品发送到经销商或用户的一系列操作,包括配货、运输等。
发运过程质量管理
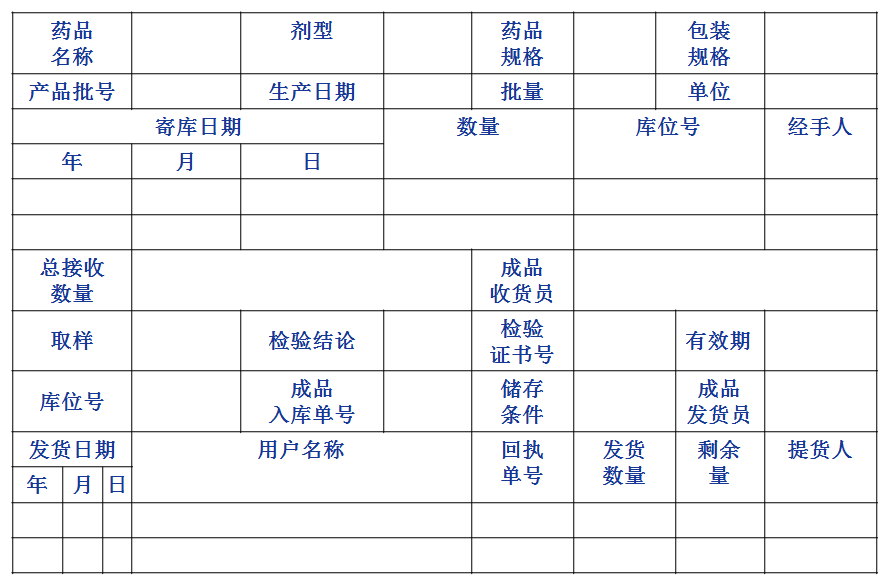
质量管理的重点是保证能追查到每批药品的出厂情况,在必要时能及时召回售出的药品。企业常采用成品库卡对成品进行管理。
发运记录的要求 应包含足够的信息,如产品名称、规格、批号、数量、收货单位和地址、联系方式、发货日期、运输方式等,使产品具有可追溯性;药品发运的零头包装只限两个批号为一个合箱,合箱外应当标明全部批号,并建立合箱记录;发运记录应由专人、专柜保管,所有记录归档保存至药品有效期后一年,但至少保存三年。
成品库卡样式
药品发运的程序
(1)药品生产企业的销售部门管理人员凭业务人员发货申请单和合同副本开具发货单。发货单应包括:发货编号、开票日期、收货单位名称和地址、产品名称、剂型、规格、批号、数量、单价和总额、付款形式、联系方式、运输方式等。如为两个批号的药品合箱时,须在发货单上注明两个批号,合箱外应当标明全部批号,建立合箱记录,药品发运的零头包装只限两个批号为一个合箱。
(2)发货的成品须为放行药品,发货人员根据发货通知单对所发药品进行复核,将待发运的药品转送至发货区。
(3)发货人员应复核发货通知单及待发货药品,填写成品发运记录,详细说明发运注意事项,特别是需要冷链运输和避光要求的药品。
七、退货
药品退货的分类
(1)质量问题退货 由质量管理部门、销售部门共同对客商提出退货的成品进行实地取样复验,并与留样检验结果比对无误或实地调查属实后,销售部管理人员办理有关手续。
(2)非质量问题退货 由销售人员提出申请,须填写“成品退货申请单”,由销售部门负责人批准后方可执行。
退货的处理
(1)非质量问题退货 外包装完好的,经共同确认,不必全检,经外观检查合格后,即可将其从退货区转移至合格区,下次销售时先行发行。验收不合格的按退货管理规程处理。
(2)质量问题退货 质量管理部门应会同销售部门、生产技术管理部门、生产车间有关人员共同进行分析,找出原因。若属质量问题且可能与相关批次有关联时,应执行药品召回管理规程,尽快追回并及时调查处理。
八 、产品召回
药品召回是指药品生产企业包括进口药品的境外制药厂商,按照规定的程序收回已上市销售的存在安全隐患的药品.
案例回放:2010年1月,欧盟人用医药产品委员会称含“西布曲明”的减肥药可增加引发心脏病及中风概率,暂停欧盟地区销售;10月,美国FDA责令此类减肥产品退市。国家食品药品监督管理局于10月底发文,停止该类减肥药的生产、销售和使用。发文前,太极集团已开始主动召回含“西布曲明”的减肥药“曲美”,因有影视明星代言,市场占有率高,引起公众关注,企业因此造成经济损失约1亿元。
药品安全隐患的调查与评估
调查内容 ①已发生不良事件的种类、范围及原因。②使用是否符合药品说明书、标签标明的适应证、用法用量的要求。③质量是否符合国家标准,生产过程是否符合GMP等规定,生产与批准的工艺是否一致。④储存、运输是否符合要求。⑤主要使用人群的构成及比例。⑥可能存在安全隐患的批次、数量及流通区域和范围。⑦其他可能影响药品安全的因素。
评估内容 ①该药品引发危害的可能性,以及是否已经对人体健康造成了危害。②对主要使用人群的危害影响。③对特殊人群,尤其是高危人群的危害影响。④危害的严重与紧急程度。⑤危害导致的后果。
药品召回依据
(1)药品留样观察中发现质量不合格情况。
(2)用户、患者、医生、客商投诉药品质量情况,经调查属实。
(3)药品质量监督管理部门抽检通报有质量问题的药品。
(4)药品经营企业、使用单位发现药品存在安全隐患的。
(5)用户反映有未知的不良反应。
(6)国家食品药品监管总局已公告撤销批准文号的药品。
(7)药品包装标签说明书内容或者设计印制存在缺陷,影响用药安全的。
(8)执行政府相关的药品召回决定。
(9)其他认为需要召回的药品。
药品召回的分类
按安全隐患严重程度分类
一级召回 使用该药品可能引起严重健康危害的。
二级召回 使用该药品可能引起暂时的或者可逆的健康危害的。
三级召回 使用该药品一般不会引起健康危害,但由于其他原因需要收回的。
按提出召回的主体分类
主动召回 药品生产企业发现药品存在安全隐患的,应当决定召回。
进口药品在境内进行召回的,由进口单位负责具体实施。
责令召回 药品生产企业应当召回而未主动召回的,食品药品监督管
理部门应当责令其召回药品。
药品召回程序
(1)药企成立召回工作组,负责紧急召回全过程处理。
人员组成:主管质量的负责人、质量受权人、销售部门负责人、仓储部门。
(2)紧急召回时,工作组应迅速做出调查评估报告,制定召回计划。
调查评估报告内容:①召回药品的具体情况,包括名称、批次等基本信息;②实施召回的原因;③调查评估结果;④召回分级。
召回计划内容:①药品生产销售情况及拟召回的数量;②召回措施的具体内容,包括实施的组织、范围和时限等;③召回信息的公布途径与范围;④召回的预期效果;⑤药品召回后的处理措施;⑥联系人的姓名及联系方式。
(3)通知销售部门及有关人员立即实施召回计划。
(4)紧急召回时,召回工作组24小时随时处理可能发生的问题。
(5)详细记录紧急召回措施、结果和时间,存入产品质量档案,并报药品监督管理部门。
(6)结束紧急召回,应以书面形式宣布并通知有关部门,同时呈报药品监督管理部门。
召回药品的处理
对召回药品的处理应当有详细的记录,并向当地的食品药品监督管理局报告。报废销毁的,在企业质量管理部门监督下予以销毁。
药品召回或退货记录
药品生产企业对召回或退货药品的处理应当有详细的记录,并向企业所在地的药品监督管理部门报告。
九、销售记录
纸质记录
销售部门及时按批次准确填写销售记录。
要求:①专人负责。②内容涵盖品名、规格、批号、数量、收货单位、地址、发货日期、货运方式、发货人、收货或联系人、检验单号。③每月复核。④保存至药品有效期后1年,至少保存3年。
电子记录
药品销售数据库和电子表格等,构成药品销售电子记录。
药品销售管理系统功能包含:销售人员管理、客商管理、销售渠道与 药品流向管理、经销商备货管理、销售计划管理、订单与合同管理、 药品发运管理、广告推广管理、费用管理、资金回笼管理、财务管理、投诉与不良反应报告管理、退货与召回管理等。


