变更 药品生产企业涉及的原辅料、包装材料、质量标准、检验方法、操作规程、厂房、设施、设备、仪器、生产工艺和计算机软件与现行状况不一致时时即为变更。按变更的性质、范围、对产品质量潜在影响的程度,变更可分为主要变更和将要变更。所有变更情况分类可由企业根据企业产品的剂型特点、产品特性、生产工艺特性、设备特性情况而定。
一、变更涉及范围
(1)产品所用原辅料的所有变更,尤其是来自新供应商的原辅料;
(2)关键中间控制点及成品的检验结果出现异常;
(3)所有不符合质量标准的批次及其调查结果;
(4)所有重大偏差及相关的调查、所采取的整改措施和预防措施的有效性考察结果不符合要求或出现异常;
(5)生产工艺或检验方法等的所有变更;
(6)已批准或备案的药品注册所有变更;
(7)稳定性考察的结果及出现的任何不良趋势;
(8)所有因质量原因造成的退货、投诉、召回及调查结果;
(9)与产品工艺或设备相关的纠正措施的执行情况和效果达不到要求和目标;
(10)新获批准和有变更的药品,按照注册要求上市后应当完成的工作需要;
(11)相关设备和设施,如空调净化系统、水系统、压缩空气等的确认状态结果不符合要求或异常;
(12)委托生产或检验的技术合同履行情况不符合要求或出现异常。
药品生产企业应当建立操作规程,规定原辅料、包装材料、质量标准、检验方法、操作规程、厂房、设施、设备、仪器、生产工艺和计算机软件变更的申请、评估、审核、批准和实施。质量管理部门应当指定专人负责变更控制。变更都应当评估其对产品质量的潜在影响。企业可以根据变更的性质、范围、对产品质量潜在影响的程度将变更分类(如主要、次要变更)。判断变更所需的验证、额外的检验以及稳定性考察应当有科学依据。与产品质量有关的变更由申请部门提出后,应当经评估、制定实施计划并明确实施职责,最终由质量管理部门审核批准。变更实施应当有相应的完整记录。
改变原辅料、直接接触药品的的包装材料、生产工艺、主要生产设备以及其他影响药品质量的主要因素时,企业应当建立变更控制系统,对所有影响产品质量的变更进行评估和管理。需要经药品监督管理部门批准的变更应当在得到批准后方可实施。上述变更还应当对变更实施后最初至少三个批次的药品质量进行评估,如果变更可能影响药品的有效期,则质量评估还应当包括对变更实施后生产的药品进行稳定性考察。变更实施时,应当确保与变更相关的文件均已修订。质量管理部门应当保存所有变更的文件和记录。
二、须再验证的变更范围
发生下列任一种情况,根据变化的大小和重要性,需做必要的再验证:
(1)处方改变;
(2)制造工艺改变;
(3)制造场所改变;
(4)相关设备变动;
(5)批量大小变动。
三、无须再验证的变更范围
如果变动认为时较小的,一般不需再验证。然而必须要有书面的评价和技术上的理由。但必须填写变动控制程序申请。
较小的变动情况主要有:①产品处方中减少或取消了色素和香料;②批量大小变化小于等于10%;制造场所改变仅发生在同一建筑物内,而生产设备、人员、操作规程、环境条件、空气洁净度等没有变化;③调换了相同设计和操作原理的生产设备。
验证后任何较小的变化均应作出评价,确保不对产品、生产工艺产生影响。
对于产品、工艺带来重大影响的变化,如原料技术等级或物理特性的改变,批量大小变化大于10%但小于等于100%,制造场所调到工厂不同的建筑物,但生产设备、人员、操作规程、环境条件、空气洁净度等没有变化,工艺条件变化等情况,若评估后认为对这种较大的变化不必再验证,但至少要做一次确认试验,即在相同的验证方案下做一次确认试验,并服从验证时的分段取样分析规则。此确认研究的结果必须记录归档。
重大变化是指诸如产品从一处移植到另一处开发生产的变化可能对产品及工艺产生重大影响的,例如制造工艺过程有重大变化,批量大小变化超过100%,调换了不同设计和操作原理的设备,如混合机型号的改变,剪力由大变小,或由小变大,假如移植产品已在原发地已做过验证或同时在进行验证,那么至少还要做2 次连续的成功验证。
变更控制程序见图10–2。
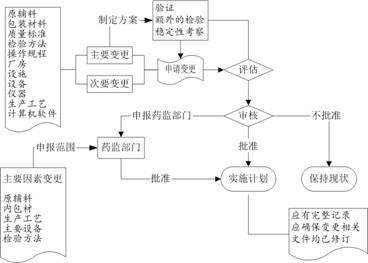
图10–2 变更控制流程图


