偏差 指对批准指令或规定标准的偏离。
在药品生产、检验及其他活动中,都会发生没有按规定程序进行操作,或操作结果不符合规定标准的情况,这些情况如果没有得到正确及时的处理,就会对药品质量产生影响。发现偏差并不一定意味着产品要报废或返工,而是要对偏差进行调查,查明原因,判断偏差轻重程度,是否会影响产品质量,影响的程度,做出产品的处理决定,同时应提出整改及预防措施,避免同样问题再出现。所以偏差处理是对不符合性事件的评价、控制和解决方法提供指导。
物料和不同生产阶段产品的检验应当至少符合以下要求:
质量控制实验室应当建立检验结果超标调查的操作规程。任何检验结果超标都必须按照操作规程进行完整的调查,并有相应的记录。
各部门负责人应当确保所有人员正确执行生产工艺、质量标准、检验方法和操作规程,防止偏差的产生。企业应当建立偏差处理的操作规程,规定偏差的报告、记录、调查、处理以及所采取的纠正措施,并有相应的记录。任何偏差都应当评估其对产品质量的潜在影响。企业可以根据偏差的性质、范围、对产品质量潜在影响的程度将偏差分类(如重大、主要、次要偏差),对重大偏差的评估还应当考虑是否需要对产品进行额外的检验以及对产品有效期的影响,必要时,应当对涉及重大偏差的产品进行稳定性考察。任何偏离生产工艺、物料平衡限度、质量标准、检验方法、操作规程等的情况均应当有记录,并立即报告主管人员及质量管理部门,应当有清楚的说明,重大偏差应当由质量管理部门会同其他部门进行彻底调查,并有调查报告。偏差调查报告应当由质量管理部门的指定人员审核并签字。
企业还应当采取预防措施有效防止类似偏差的再次发生。质量管理部门应当负责偏差的分类,保存偏差调查、处理的文件和记录
一、药品生产企业可能出现的偏差
(1)物料平衡超出允许的正常偏差;
(2)生产过程时间控制超出工艺规定范围;
(3)生产过程工艺条件发生偏移、变化;
(4)生产过程中设备发生异常,可能影响产品质量;
(5)产品质量发生偏移;
(6)非工艺损失;
(7)标签实用数、剩余、残损数之和与领用数发生差额;
(8)生产中发生其它的异常情况。
二、生产过程中偏差处理程序
(1)偏差发现人在采取措施仍不能将偏差控制在规定范围内时,立即停止生产并报告车间主任。
(2)发现偏差时,车间管理人员进行调查,根据调查结果提出处理措施。偏差处理措施有:确认不影响产品最终质量的情况下可继续加工;确认不影响产品质量的情况下进行返工,或采取补救措施;确认影响产品质量,则报废或销毁。
(3)由QA填写偏差调查处理报告两份,内容包括:品名、批号、规格、批量、工序、偏差的内容,发生的过程及原因、地点、日期;偏差调查处理报告经填表人签名后送交生产部和质量管理部门。质量管理部门认真审核偏差调查结果及需采取的措施,最后批准、签字。
(4)生产部技术部门和质量管理部门派员到车间督促检查偏差处理情况。
(5)如调查发现有可能与本批前后生产批次的产品有关联,则必须立即通知质量管理部,采取措施停止相关批次的放行,直到调查确认与之无关方可放行。
(6)处理完成后,车间将偏差处理情况及相关资料汇入批生产记录。
(7)生产过程中出现重大质量事故和重大损失时,必需按事故报告规程向有关负责人和上级主管部门及时报告。
出现偏差应制定并采取纠正措施,并有相应的记录。偏差处理流程见图10–3。
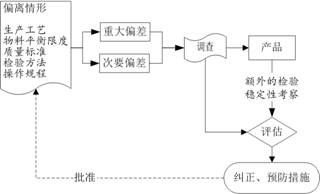
图10–3 偏差处理流程图
拓展阅读
生产过程中偏差处理方法
在发生偏差时,为了避免、减少可能的损失,如果可能的话,生产人员应及时对产品做好标记,尽可能地将发生偏差前、偏差中、偏差处理完恢复正常后的产品分开,单独作为若干小批。根据批的定义,同一批产品应当具备质量的均一性。发生偏差前后的产品显然有可能存在质量差异。分批后,质量评价人员在评价时,可以针对发生偏差的小批作出专门的决定。以免一旦需要报废,因无法区分偏差前后的产品而不得不将整个批号全部作报废处理。


