纠正和预防措施是“纠正措施”和“预防措施”的合写,简称CAPA。纠正措施(corrective action)是指为了消除导致已发现的不符合或其他不良状况的原因所采取的行动。预防措施(preventive action)是指为了消除可能导致潜在的不符合或其他不良状况的诱因所采取的行动。
一、实施纠正与预防措施的目的
企业应当建立纠正措施和预防措施系统,对投诉、召回、偏差、自检或外部检查结果、工艺性能和质量监测趋势等进行调查并采取纠正和预防措施。调查的深度和形式应当与风险的级别相适应。纠正措施和预防措施系统应当能够增进对产品和工艺的理解,改进产品和工艺。为有效解决产品质量、GMP相关系统及工艺过程中产生的不符合,纠正和预防措施必须融人质量体系中的各个分支系统。纠正和预防措施的质量数据来源于偏差、召回、OOS、客户投诉、产品缺陷、自检、外部审计检查的缺陷项、变更控制、工艺性能和产品质量监测趋势、退货、环境监测、稳定性数据、物料平衡/收率、审计、校验/维护、维修、产品质量回顾等。对质量数据进行分析,确定已有和潜在的质量问题。必要时,应当采用适当的统计学方法;调查与产品、工艺和质量保证系统有关的原因;确定所需采取的纠正和预防措施,防止已出现的不合格、缺陷或其他不希望情况的再次发生,消除其直接原因和潜在原因;评估纠正和预防措施的合理性、有效性和充分性;对实施纠正和预防措施过程中所有发生的变更应当予以记录;确保相关信息已传递到质量受权人和预防问题再次发生的直接负责人;确保相关信息及其纠正和预防措施已通过高层管理人员的评审。
质量体系中出现了不良趋势,如果不及时处理,将会导致质量问题;处理已经出现的质量问题,可以避免势态进一步恶化或重复发生。因此当药品生产企业发生偏差及其他问题以后,应当对偏差、投诉、召回、自检或外部检查结果、工艺性能和质量监测趋势等进行调查并采取措施,即纠正和预防措施。
拓展阅读
纠正及预防措施“寻根”
造成不合格、缺陷或潜在问题及不良趋势的原因通常存在于以下情况中:①生产能力不足;②工艺没有经过有效验证或没有正确的执行工艺验证;③工艺装备、测试设备和环境方面存在问题,例如设备能力不足、测试设备与要求不适应,设备缺乏维修保养,环境温湿度等条件对设备或检测产生影响;④工艺控制和检验方面存在问题,例如工艺控制不当、操作不符合程序规定、操作者/检验者因缺乏培训而不具备相应技能、检验规程不准确不全面等;⑤分析方法未能满足要求或没有正确的执行分析方法等;⑥物料及生产现场管理方面存在问题,例如使用了未经检验的物料或物料标识不清造成混料或错料,生产现场状态不清造成混淆等。
二、纠正与预防措施的流程
纠正和预防措施的程序如下:
![KSV]7UV`I5%OI2)A{2H[[LW.png](http://p.ananas.chaoxing.com/star3/origin/172755a8c5c1ad7d45c518c84c43e0be.png)
1.问题定义与风险评估
对发现的问题进行记录。发生了什么事情、在哪里发生、何时发生的、怎么发生的、谁发现的、评估缺陷的严重程度和影响范围。
2.问题调查
问题调查即原因分析,运用质量工具分析根本原因并评价。通过分析造成不合格、缺陷或潜在问题及不良趋势的原因,最终找到问题产生的根本原因。找到已发生问题的原因后,才能为制定纠正措施奠定基础。同时还需要进一步对产生这些问题的潜在原因进行具体分析,才能够制定预防措施,预防这些问题在企业中再次发生。
纠正和预防措施的制定要确定缺陷项目事实、纠正已经发生的缺陷、找出其他类似的缺陷项目、对缺陷项目产生的原因进行调查和分析、提出有效地消除该原因的措施。
3.CAPA计划批准与发布
CAPA措施制定出后,一般由质量管理部门和相关职能部门进行认可,目的是确保纠正和预防措施实施的有效性。纠正和预防措施的有效性评估内容:有效、高效、可控。
CAPA措施经过认可后,还需对CAPA措施进行批准,其目的是为CAPA措施实施创造有效条件,确保CAPA措施能够有效实施。CAPA措施一般由企业质量负责人批准,如果CAPA措施涉及到几个部门,企业质量负责人需要加以协调,必要时报请企业生产负责人批准。经批准后的CAPA措施,可由相关部门和人员付诸实施。
4.CAPA措施的执行
CAPA措施完成期限可以根据纠正和预防措施的内容和难易程度而定,一般CAPA措施完成期限:严重缺陷项且一般为三个月;一般缺陷项目正常为一个月;性质轻微的缺陷项目可在现场立即纠正。
纠正和预防措施在执行过程籼口遇到客观原因不能按期完成时,其执行部门须向企业质量管理负责人或质量管理部门说明膝因,请求延期,得到质量负责人批准后,修改纠正和预防措施实施计划。
5.纠正和预防措施的跟踪确认
纠正和预防措施的跟踪确认目利是促使相关部门采取和实施有效的纠正和预防措施,防止缺陷项目的再次发生;确认纠正和预防措施的有效性;确保消除存在的严重缺陷项目。
跟踪确认一般由质量管理部门负责,通常由质量保证(QA)负责管理并建立相关管理程序,以确保跟踪确认正常有序地实施。
根据缺陷项目的性质,可采取不同的纠正和预防措施跟踪确认方式。主要有文件检查、现场复查、提交纠正和预防措施实施方案在下一次企业自检中复查等确认方式。
在对纠正和预防措施的跟踪确认过程中要确认的实施及效果方面的内容包括以下几个方面:
①纠正和预防措施计划中的各项措施在规定的时间内要全部完成。
②完成后的效果要达到预期要求;措施完成情况有记录可查。
③措施执行如果引起了程序更改,程序更改的内容应有效,更改后的文件应按文件控 制规定进行起草、批准和发放,并得到执行。
④措施执行引起的相关文件资料如验证文件、变更申请、培训记录等相关资料应该完整。
6.纠正和预防措施关闭
质量管理部门针对缺陷项目进行了跟踪验证以后,确认其有效性,在纠正预防措施确认记录中填写确认结论并签字确认,这项缺陷项目就可宣布关闭。
实施纠正和预防措施的过程和效果都应有记录,记录主要包括不符合项的描述;涉及的范围,有无其他潜在影响;不符合项的风险或危害评估;调查过程;采取的纠正和预防措施及措施的负责人及完成日期;结论;纠正和预防措施有效性评估;纠正和预防措施的批准等。
纠正和预防措施管理流程见图10–4。
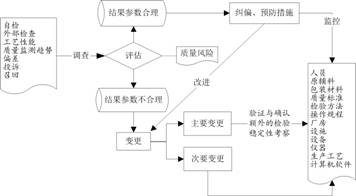
图10–4 纠正和预防措施管理流程图


