一、学习目标
1.通过实验方案设计、操作、观察分析,探究Na2O2与H2O的反应历程及漂白原理的理解;
2.了解数字化实验的应用及实验图像的数据分析;
二、微教学设计
教学
环节
教师活动
学生
活动
设计意图
环节一
创设情境
引入课题
【实验导入】魔术:“滴水生火”
【思考】水能灭火,亦能生火。为什么滴水能使脱脂棉燃烧呢?
欣赏
吸引学生注意,轻松愉快心情进入课堂
【分析】其实我们在脱脂棉上放了少许淡黄色固体,对了,就是我们之前学过的过氧化钠,加水之后发生了化学反应。脱脂棉能燃烧,说明这个反应放出来大量的热。可为啥如此剧烈呢?
倾听
观看
思考
激发学生学习兴趣,做好学习准备。
环节二
实验探究
检验产物
【实验1】过氧化钠与水反应,并用带火星的木条检验生成的气体
【讲述】在试管中加入适量的过氧化钠和水,我们可以看到剧烈反应,过氧化钠瞬间消失,有大量气泡生成,说明反应产生了气体,这种气体是氢气还是氧气呢?此时向试管中插入带火星的木条,木条复燃,证明反应产生了氧气。
【揭秘】这里过氧化钠与水反应生成的氧气为其燃烧提供了助燃剂,因此棉花燃烧非常剧烈。
【思考】还可能有什么产物?
【引导】根据元素守恒,还有钠和氢元素,类比氧化钠和水反应生成氢氧化钠的反应,可能还有氢氧化钠生成。如何设计实验来验证?
【实验2】往反应后的溶液滴加酚酞,振荡
【现象】可以观察到溶液先变红后褪色
倾听
思考
体会
思考
通过实验方案设计、操作、观察分析,提高学生获知信息的能力。
环节三
发现异常
深入探究
【引导】酚酞试液变红证明生成了碱性物质氢氧化钠,是什么使溶液先变红后褪色呢?
如果反应只生成了氢氧化钠和氧气,实验过程中是不会出现溶液颜色褪去这一现象的。我们可以推测反应中有别的生成物与酚酞发生反应而褪色。
【资料】1、Na2O2与H2O的反应过程中先生成H2O2;
2、酚酞是有机物质,在遇到H2O2时其结构会被破坏,不再显色
【思考】如何设计实验验证过氧化氢的存在呢?
【实验3】反应后的溶液加二氧化锰,伸入带火星的木条并过滤,往滤液中滴加酚酞
【结论】有大量气体产生,带火星的木条复燃,说明生成的气体是氧气。将得到的混合物进行过滤,滤出二氧化锰,在滤液中滴加酚酞,溶液变红。这个实验说明在过氧化钠与水反应的过程中除氢氧化钠外还生成了过氧化氢,过氧化氢可以使红色的酚酞褪色,当过氧化氢被二氧化锰催化分解后,溶液中只有氢氧化钠,再加入酚酞后,溶液只变红不褪色。有过氧化氢存在,而过氧化氢破坏了酚酞的结构,使其褪色。
【结论】所以,Na2O2与H2O2 是分步反应,H2O2为中间产物。第一步,过氧化钠与水发生复分解反应,第二步,过氧化氢发生分解反应。
【思考】可是在随后的实验废液处理的时候,将废液倒入废液池中,碱液又马上变红。
【资料】1.NaOH浓度太高,酚酞不变红或者变红后迅速褪色;
2.Na2O2也具有漂白性,能使酚酞溶液褪色
【讲述】在查找了一些资料后发现,在碱性溶液中,酚酞的变色范围是:在pH值介于8.2~10.0之间,溶液变红;而pH值大于10.0,溶液不变红。可能生成的NaOH浓度太高,酚酞不变红或者变红后迅速褪色。将反应后的溶液倒入废液池中,相当于稀释,降低氢氧化钠的溶度,达到酚酞的变色范围,溶液又马上变红。
其实过氧化钠也具有漂白性,如果反应中过氧化钠的量较多,同样也会使酚酞溶液褪色。
【小结】总而言之,我们观察到的溶液褪色的异常现象和以下三个因素有关,氢氧化钠溶液浓度太高会使酚酞不变红或者变红后迅速褪色;过氧化钠和过氧化氢都具有漂白性,会使酚酞变红后迅速褪色。
观看
实验
倾听
实验探究
直观环保
观察启发
加深理解
发现问题
研究问题
环节四
了解数字化实验
【介绍】手持技术
【分析】pH变化曲线表明过氧化钠与水的反应溶液的pH随着反应的进行而升高,随着反应进行完全,pH不再变化。反应中有碱性物质即氢氧化钠生成。
通过温度变化曲线可以看出往水中加入氢氧化钠后,温度迅速升高,说明反应放热。
用氧气传感器检测反应装置内氧气百分含量的变化,分析数据,往过氧化钠中加水后,氧气的百分含量上升至不再变化,说明过氧化钠与水反应产生了氧气;再加入少量二氧化锰后,氧气的百分含量迅速升高,说明有中间产物过氧化氢生成。而且导致酚酞褪色的主要原因是过氧化氢。
以上我们探究了过氧化钠与水反应的原理,设计实验验证了氧气、氢氧化钠产物的存在,主要探究了酚酞溶液变红又褪色的原因。最后见识了数字化实验的便捷直观。
思考
数字化实验的介绍让学生感受到现代科技给化学带来的改变,让学生眼前一亮。
三、微视频
四、在线微检测
五、学习资源
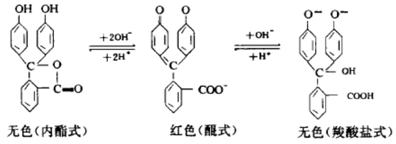
酚酞是4,4-二羟基三苯甲醇-2-羧酸的内酯,无色,不溶于水,溶于有机溶剂。遇碱时,内酯开环而生成二钠盐,发生重排,形成醌式结构而呈玫瑰红色, 醌基是显色基团(红),但在强碱溶液中不稳定而形成无色的三钠盐。其反应如下:
结论:高浓度的氢氧化钠溶液可以使酚酞溶液褪色。
在相同条件下,分别往不同物质的量浓度的NaOH溶液中加入2滴酚酞,观察并记录酚酞褪色的时间。

![QC~6`J`K%]DD$G21)[QRSFG.png](http://p.ananas.chaoxing.com/star3/origin/972a9d87cb8d40d0fc0a6bfb1b31306c.png)

