知识目标
1、了解抗原的加工、处理和呈递过程
2、了解APC与T淋巴细胞之间的相互作用
课前思考
1. 抗原是如何被抗原呈递细胞加工、处理、呈递的?
2. APC是如何将抗原递呈给特异性T细胞的?
3. T淋巴细胞是如何被激活的?
教学内容
抗原递呈、APC与T细胞的相互作用
抗原递呈
T细胞借助其表面TCR识别抗原物质,但一般不能直接识别可溶性蛋白抗原,而仅识别与MHC分子结合成复合物的抗原肽:CD4+T细胞识别APC表面抗原肽-MHC-Ⅱ类分子复合物;CD8+T细胞识别靶细胞表面抗原肽-MHC-I类分子复合物。细胞将胞浆内自身产生或摄入胞内的抗原消化降解为一定大小的抗原肽片段,以适合与胞内MHC分子结合,此过程称为抗原加工(antigen processing)或抗原处理。抗原肽与MHC分子结合成抗原肽-MHC分子复合物,并表达在细胞表面,以供T细胞识别,此过程称为抗原递呈(antigen presenting)。APC或靶细胞对抗原进行加工与递呈,是 TD抗原诱导特异性免疫应答的前提。
根据被递呈抗原的来源不同,可将其分为:
1、外源性抗原(exogenous antigen):来源于细胞外的抗原,如被吞噬的细胞、细菌或某些自身成分等。APC加工处理外源性抗原后形成的抗原肽,常由MHC-Ⅱ类分子递呈给CD4+T细胞,此为溶酶体途径或MHC-Ⅱ类途径。
2、内源性抗原(endogenous antigen):是细胞内合成的抗原,如病毒感染细胞所合成的病毒蛋白、肿瘤细胞合成的蛋白以及胞内某些自身正常成分等。内源性抗原在胞内加工后形成的抗原肽则与MHC-I类分子结合,递呈给CD8+T细胞,此为胞质溶胶途径或MHC-I类途径。
一、外源性抗原的加工、处理和呈递
(一)外源性抗原的加工处理
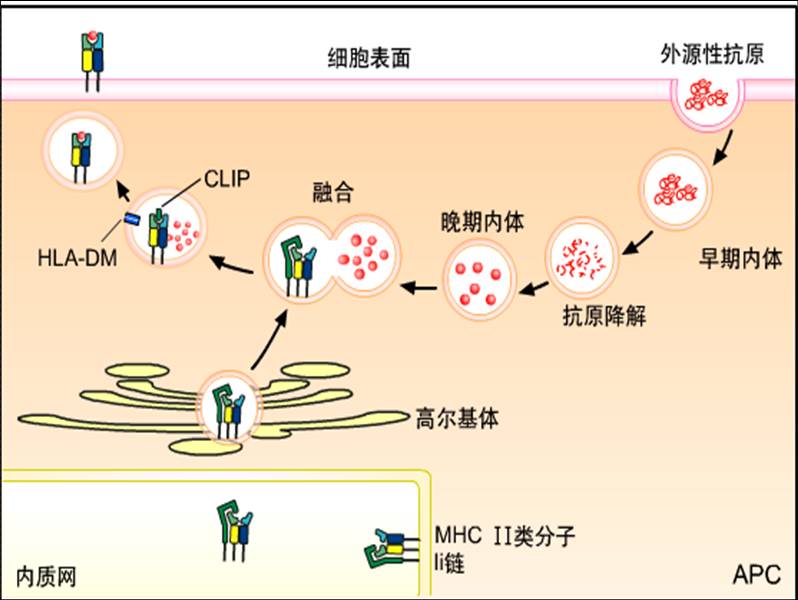
APC通过胞吞作用(endocytosis)或称内化作用(internalization)而摄入外源性抗原,包括吞噬、吞饮或受体介导的内吞作用。所摄入的外源性抗原由胞浆膜包裹,在胞内形成内体(endosome),逐渐向胞浆深处移行,并与溶酶体融合形成内体/溶酶体。内体/溶酶体中含有组织蛋白酶、过氧化氢酶等多种酶,且为酸性环境,可使蛋白抗原降解为含13~18个氨基酸的肽段,适合与MHC-Ⅱ类分子结合。
(二)MHC-Ⅱ类分子的生成和转运
MHC-Ⅱ类分子α链和β链在粗面ER中生成,并在钙联蛋白参与下折叠成异二聚体,插入粗面ER膜中。粗面ER膜上存在Ia相关的恒定链(Ia-associated invariant chain,Ii链),与MHC-Ⅱ类分子结合,形成九聚体(abIi)3复合物。Ii链的作用是:①参与α链和β链折叠和组装,促进MHC-Ⅱ类分子二聚体形成;②阻止粗面ER中内源性肽与MHC-Ⅱ类分子结合;③促进MHC-Ⅱ类分子从ER移行,经高尔基体进入MIIC。
胞内合成的MHC-Ⅱ分子被高尔基体转运至一囊泡样腔室,后者称为MHC-Ⅱ类分子腔室(MHC classIIcompartment, MIIC)。含外来抗原多肽的内体/溶酶体可与MIIC融合。随后,在酸性蛋白酶作用下,使与MHC-Ⅱ类分子结合的Ii链被部分降解,仅在MHC-Ⅱ类分子抗原肽结合槽中残留一小段,称为II类分子相关的恒定链多肽(classII-associated invariant
chainpeptide, CLIP)。
(三)MHC-Ⅱ类分子组装和递呈抗原肽
MHC-Ⅱ类分子的α1和b1功能区折叠为2个α螺旋和1个β片层,形成抗原肽结合沟槽,其两端为开放结构,使与之结合的多肽在N端及C端可适当延伸,最适的多肽长度在13~18个氨基酸之间。
存在于MIIC中的MHC-Ⅱ类分子,其抗原肽结合槽由CLIP占据,故不能与抗原肽结合。HLA-DM分子(属非经典MHC-Ⅱ类分子)可使CLIP与抗原肽结合沟槽离解,此时抗原肽才可与MHC-Ⅱ类分子结合为复合物。抗原肽-MHC-Ⅱ类分子复合物随MIIC向细胞表面移行,通过胞吐作用(exocytosis)而表达于细胞表面,供CD4+T细胞识别,完成外源性抗原肽递呈过程。
二、内源性抗原的加工、处理和呈递
(一)内源性抗原的加工处理和转运
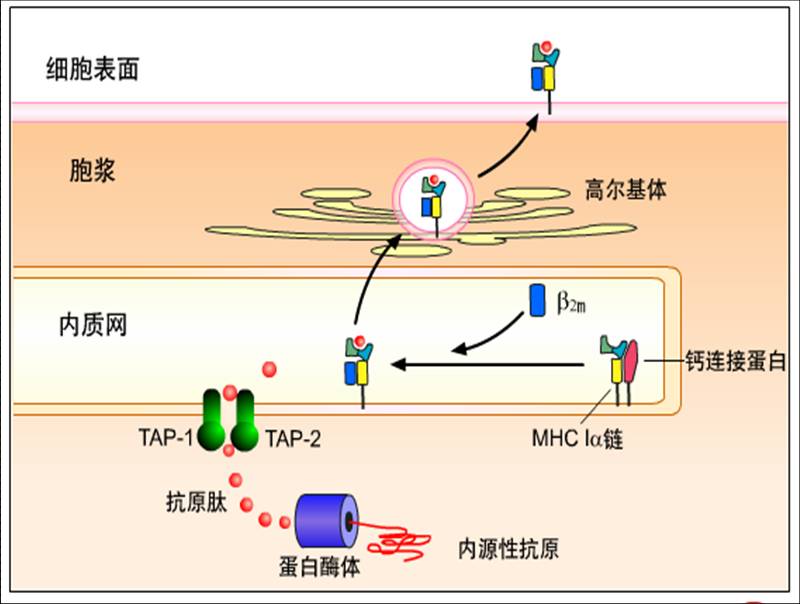
胞内合成的内源性抗原在胞浆内被处理和转运。内源性抗原在多种酶和ATP的作用下与泛素结合,泛素化的内源性抗原被解除折叠,以线形进入蛋白酶体(proteosome)。蛋白酶体(20S)是存在于细胞内的一种大分子量蛋白质水解酶复合体,具有广泛的蛋白水解活性。蛋白酶体为中空(孔径约1~2nm)的圆柱体结构,内源性蛋白通过蛋白酶体的孔道,可被降解为含6~30个氨基酸的多肽片段。蛋白酶体由4个各含7个球形亚单位的圆环串接而成,其具有酶活性的组分主要是两种低分子量多肽(low molecular weight peptide, LMP),包括LMP2和LMP7(属于非经典MHC-Ⅱ类基因产物)。
经蛋白酶体降解的抗原肽片段须进入内质网(ER)才能与MHC-I类分子结合,该过程依赖于ER的抗原加工相关转运体(transporter associated with antigen processing, TAP)。TAP由TAP1和TAP2两个亚单位组成,是ER膜上的跨膜蛋白,各跨越ER膜6次,共同在ER膜上形成孔道。
胞浆中的抗原肽先与TAP的胞浆区结合,在TAP分子的ATP结合结构域作用下,使ATP降解,导致TAP异二聚体结构改变,孔道开放,抗原肽通过孔道进入ER腔。
TAP可选择性转运适合与MHC-I类分子结合的肽段,其机制为:①TAP能选择性转运含8~12个氨基酸、适合与MHC-I类分子结合的抗原肽;②TAP优先选择C端为碱性或疏水性残基的多肽片段,这些残基乃抗原肽与MHC-I类分子结合的锚着残基。
(二)MHC-I类分子的生成和组装
MHC-I类分子的重链(α链)和轻链(β2m)在粗面ER中合成后,被转运至光面ER。在ER中,MHC-I类分子须立即与某些伴随蛋白(chaperone)[如钙联蛋白(calnexin)、钙网蛋白(calreliculin)和tapasin] 结合。此类蛋白的作用是:参与α链的折叠及与β2m组装成完整的MHC-I类分子;保护α链不被降解;帮助MHC-I类分子与TAP结合。
(三)MHC-I类分子组装和递呈抗原肽
在伴随蛋白参与下,MHC-I类分子组装为二聚体,其 α链的α1及α2功能区构成抗原肽结合沟槽,沟槽的两个侧面为α螺旋,底面为β片层结构。MHC-I类分子沟槽纵向的两端是封闭的,能结合含8~12个氨基酸的多肽。
MHC-I类分子与ER上的TAP相连,再与经TAP转运的抗原肽结合,形成抗原肽-MHC-I类分子复合物,然后与TAP、伴随蛋白解离,移行至高尔基体,通过分泌囊泡再移行至细胞表面,递呈给CD8+T细胞。
APC与T细胞的相互作用
APC将抗原递呈给特异性T细胞,该过程涉及两种细胞表面多种分子间的相互作用,形成免疫突触(immune synapse)。
一、T细胞与APC的非特异性结合
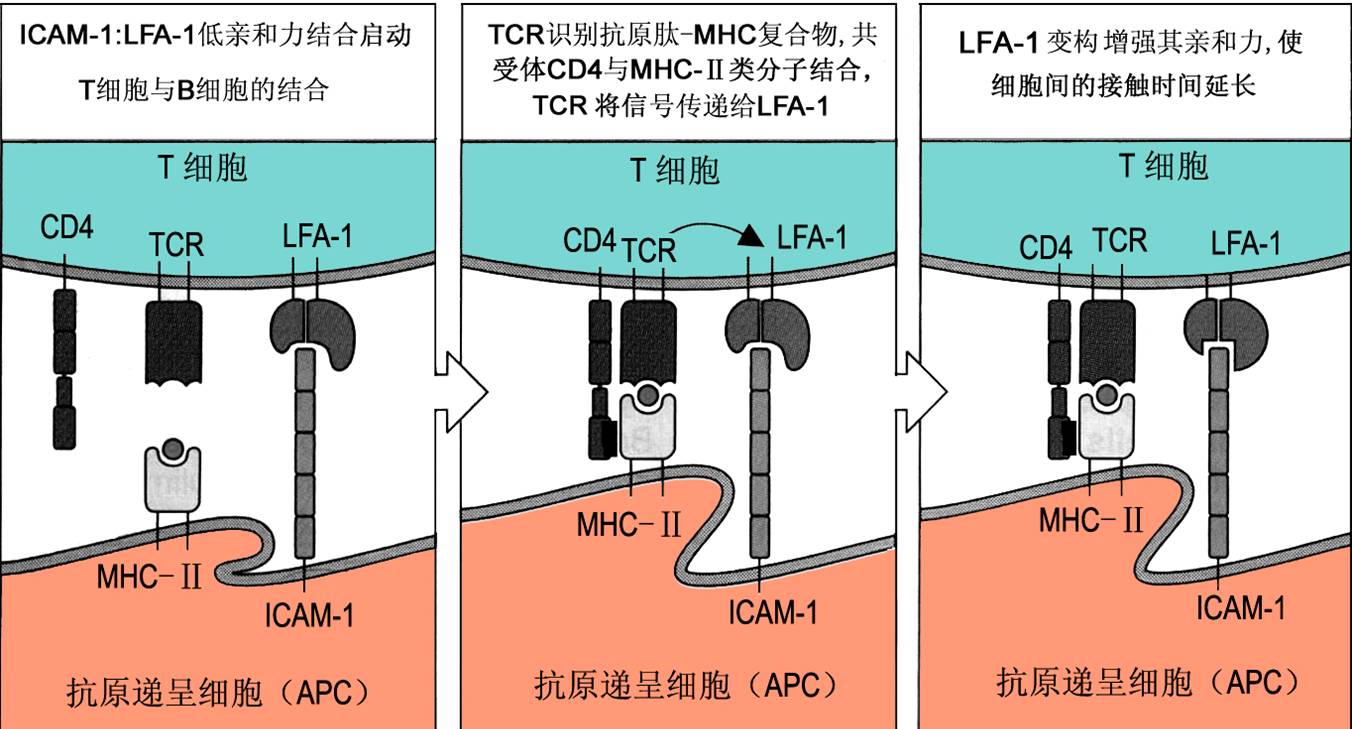
初始T细胞进入淋巴结皮质区深部,即与该处APC(成熟DC等)接触,T细胞表面的黏附分子(LFA-1、CD2、ICAM-3)与APC表面相应受体(ICAM-1或ICAM-2、LFA-3)短暂结合。这种非特异性、可逆性的结合,可为TCR提供机会,从APC表面大量抗原肽-MHC分子复合物中筛选特异性抗原肽。若未能遭遇特异性抗原,T细胞即与DC分离,离开淋巴结而进入血循环。
二、T细胞与APC的特异性结合
上述APC与T细胞短暂结合过程中,若TCR遭遇特异性抗原肽,则T细胞与APC发生特异性结合,并由CD3分子向胞内传递特异性识别信号,导致LFA-1变构并增强其与ICAM的亲和力,从而稳定并延长APC与T细胞间的接触(可持续数天),以有效诱导抗原特异性T细胞激活和增殖。增殖的子代细胞仍与APC黏附,直至分化为效应细胞。
此外,在T细胞与APC的特异性结合中,T细胞表面CD4与CD8分子是TCR识别抗原的共受体(co-receptor)。CD4和CD8可分别与APC(或靶细胞)表面MHC-Ⅱ和MHC-Ⅰ类分子结合,从而增强TCR与特异性抗原肽-MHC分子复合物结合的亲和力,使T细胞对抗原应答的敏感性增强(约100倍)。
三、T细胞和APC表面共刺激分子的结合
APC和T细胞表面均表达多种参与两类细胞相互作用的黏附分子对,又称共刺激分子(co-stimulatory molecule),它们的结合有助于维持、加强APC与T细胞的直接接触,并为T细胞激活提供共刺激信号(co-stimulatory signal)。

四、T细胞活化、增殖和分化
通常情况下,体内表达某一特异性TCR的T细胞克隆仅占总T细胞库的1/105~1/104。数量极少的特异性T细胞仅在被抗原激活后,通过克隆扩增而产生大量效应细胞,才能有效发挥作用。
(一)T细胞活化
接受抗原刺激后,T细胞的完全活化有赖于双信号和细胞因子的作用。
1、T细胞活化的第一信号
APC将抗原肽-MHC分子复合物递呈给T细胞,TCR特异性识别结合于MHC分子凹槽中的抗原肽,引起TCR交联并启动抗原识别信号(即第一信号),导致CD3和共受体(CD4或CD8)分子的胞浆段尾部相聚,激活与胞浆段尾部相连的酪氨酸激酶,促使含酪氨酸的蛋白磷酸化,启动激酶活化的级联反应,最终通过激活转录因子而导致细胞因子及其受体等的基因转录和产物合成。
2、T细胞激活的第二信号
仅有TCR来源的抗原识别信号尚不足以有效激活T细胞。APC和T细胞表面多种黏附分子对(如B7/CD28、LFA-1/ ICAM-1或ICAM-2、CD2/ LFA-3等)结合,可向T细胞提供第二激活信号(即共刺激信号),从而使T细胞完全活化。
CD28/B7是重要的共刺激分子,其主要作用是促进IL-2合成。在缺乏共刺激信号的情况下,IL-2合成受阻,则抗原刺激非但不能激活特异性T细胞,反而导致T细胞失能(anergy)。激活的专职APC高表达共刺激分子,而正常组织及静止的APC则不表达或仅低表达共刺激分子。缺乏共刺激信号使自身反应性T细胞处于无能状态,从而有利于维持自身耐受。
此外,CTLA4与CD28具有高度同源性,该分子与B7的亲和力比CD28高约20倍。CD28/B7参与T细胞的激活,但在T细胞激活至峰值后CTLA4表达则增加,后者与B7结合可启动抑制性信号,从而有效制约特异性T细胞克隆过度增殖。
3、细胞因子促进T细胞充分活化
除上述双信号外,T细胞的充分活化还有赖于细胞因子参与。活化的APC和T细胞可分泌IL-1、IL-2、IL-6,IL-12等多种细胞因子,它们在T细胞激活中发挥重要作用。
(二)T细胞增殖和分化
1、T细胞增殖、分化及其机制
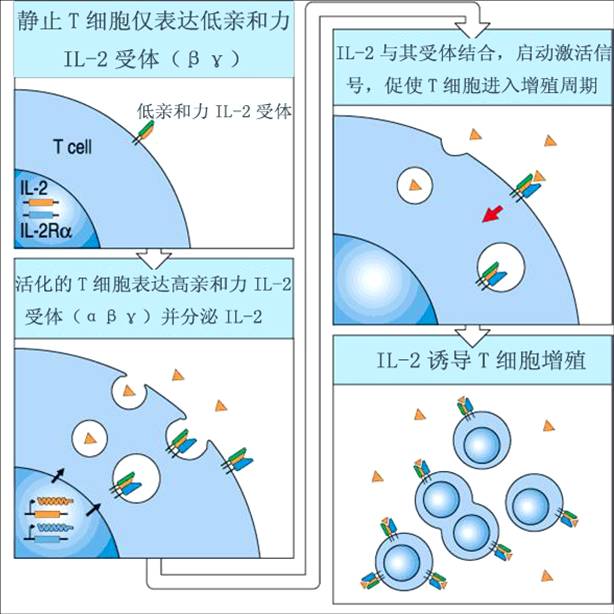
激活的T细胞迅速进入细胞周期,通过有丝分裂而大量增殖,并分化为效应T细胞,然后离开淋巴器官随血循环到达感染部位。多种细胞因子参与T细胞增殖和分化过程,其中最重要者为IL-2。IL-2受体由α、β、γ链组成,静止T细胞仅表达低亲和力IL-2R(β.γ);激活的T细胞可表达高亲和力IL-2R(α.β.γ)并分泌IL-2。通过自分泌及旁分泌作用,IL-2与T细胞表面IL-2R结合,介导T细胞增殖和分化。此外,IL-4、IL-12、IL-15等细胞因子也在T细胞增殖和分化中(尤其Th1与Th2细胞的分化调控中)发挥重要作用。T细胞的增殖、分化。
T细胞经迅速增殖4-5天后,分化为可高表达效应分子(包括膜分子和分泌型细胞因子等)的效应T细胞(Th细胞或CTL)。同时,部分活化的T细胞可分化为长寿命记忆性T细胞,在再次免疫应答中起重要作用。
2、CD4+T细胞的增殖分化
初始CD4+T被激活、增殖和分化为Th0细胞。局部微环境中存在的细胞因子种类是调控Th0细胞分化的关键因素,例如:IL-12可促进Th0细胞定向分化为Th1细胞;IL-4可促进Th0细胞分化为Th2细胞。Th0细胞的分化方向是决定机体免疫应答类型的重要因素:Th1细胞主要介导细胞免疫应答;Th2细胞主要介导体液免疫应答。
3、CD8+T细胞的增殖和分化
初始CD8+T细胞的激活主要有两种方式:
(1)Th细胞非依赖性:如病毒感染的DC,由于其高表达共刺激分子,可直接刺激CD8+T细胞合成IL-2,促使CD8+T细胞自身增殖并分化为细胞毒T细胞,而无需Th细胞辅助。
(2)Th细胞依赖性:CD8+T细胞作用的靶细胞一般仅低表达或不表达共刺激分子,不能激活初始CD8+T细胞,而需要APC及CD4+T细胞的辅助。
(三)活化T细胞的转归
1、活化T细胞转变为记忆T细胞,参与再次免疫应答
机体对特定抗原产生初次免疫应答后,部分活化的T细胞可转变为记忆T细胞(Tm)。当抗原再次进入机体,仅需少量抗原即可激活Tm,迅速产生强烈、持久的应答。
2、活化T细胞发生凋亡,以及时终止免疫应答
活化的淋巴细胞发生凋亡有助于控制免疫应答强度,以适时终止免疫应答和维持自身免疫耐受。活化淋巴细胞凋亡涉及两条途径。
(1)活化诱导的细胞死亡(activation induced cell death,AICD):激活的T细胞可高表达死亡受体Fas及Fas配体(Fas ligand,FasL),二者结合后可启动Caspase酶联反应而导致细胞凋亡。AICD有助于控制特异性T细胞克隆的扩增水平,从而发挥重要的负向免疫调节作用。
(2)被动细胞死亡(passive cell death,PCD):在免疫应答晚期,由于大量抗原被清除,淋巴细胞所接受的抗原刺激和生存信号及所产生的生长因子均减少,导致胞内线粒体释放细胞色素C,通过Caspase酶联反应而致细胞凋亡。









