主要二级结构形式
上一节
下一节
蛋白质二级结构主要类型

★α-螺旋(α-helix):盘曲程度较高的形态,最常见
★β-折叠(β-pleated sheet):伸展的状态,也比较常见
★β-转角(β-turn):肽链中的回折
★无规则卷曲(random coil):无特定结构特征的状态
1.α-螺旋

★右手螺旋
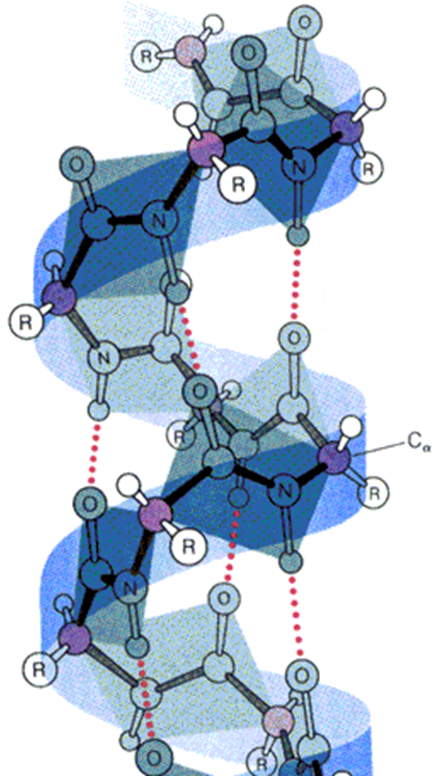
★氨基与羰基形成的氢键是稳定螺旋的主要
作用力
★螺旋每圈3.6 个氨基酸
★侧链基团位于螺旋外侧
★为什么组成蛋白质的氨基酸都是L 型的?
影响 α-螺旋形成的因素

★过多的带相同电荷的 R 基团,如:Glu、Lys
★过多的大 R 基团,如:Leu、Ile、Asn
★间隔 3-4 残基的 R 基团间的相互作用:
*酸性、碱性侧链的离子键
*芳香族侧链间的疏水相互作用
★Pro 无法形成α-螺旋:
*分子的刚性
*形成肽键的 N 原子无 H,不能形成氢键
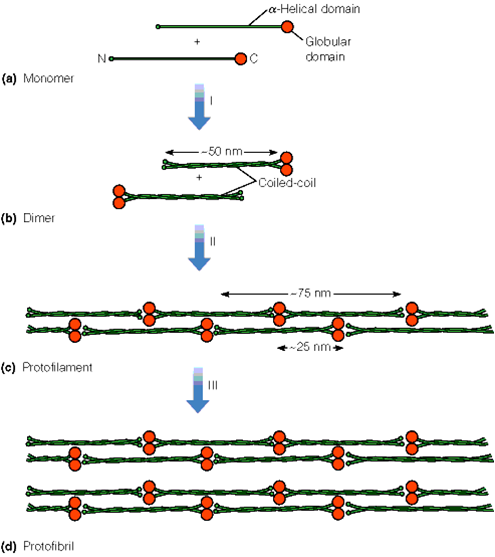
α-角蛋白的结构

★α-角蛋白(keratin)是毛发中的主要蛋白
★主要由α-螺旋捆扎形成的微纤维
★α-螺旋间由二硫键形成交联
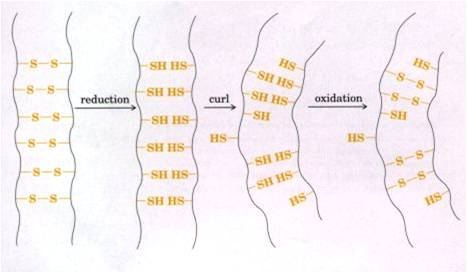
烫发:一项蛋白质结构工程

★烫发就是角蛋白二硫键还原、扭曲和再氧化的过程
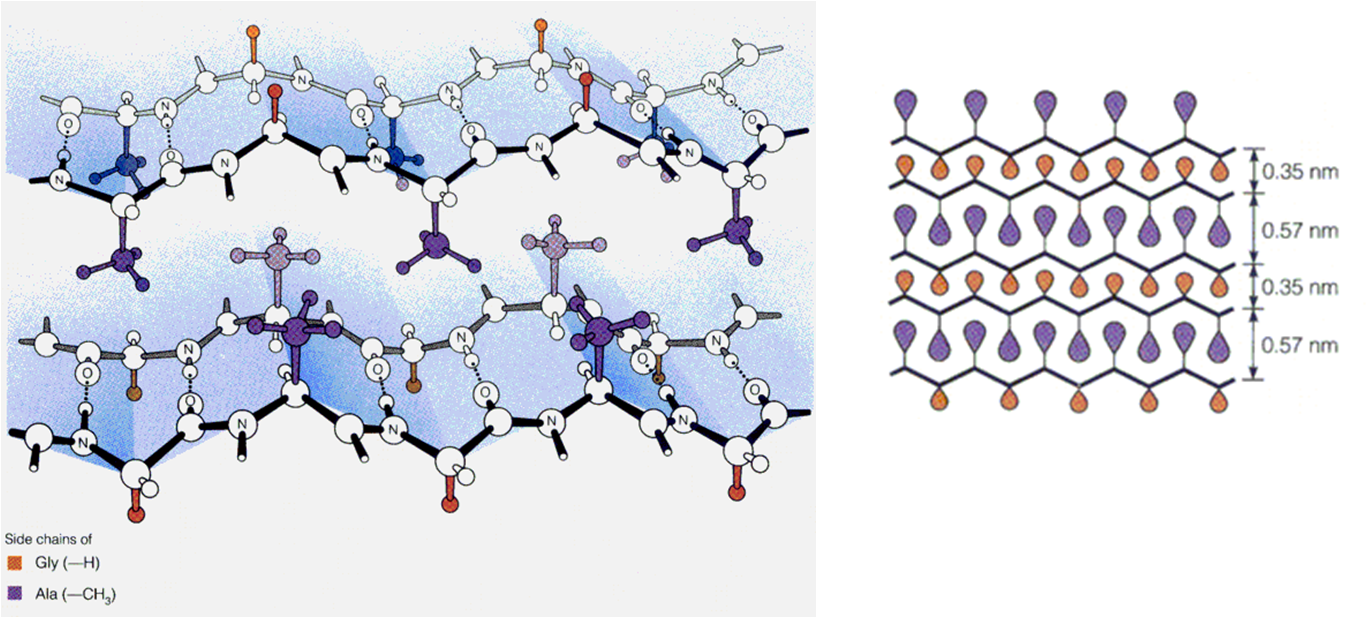
2.β-折叠

★若干多肽链正向或反向平行排列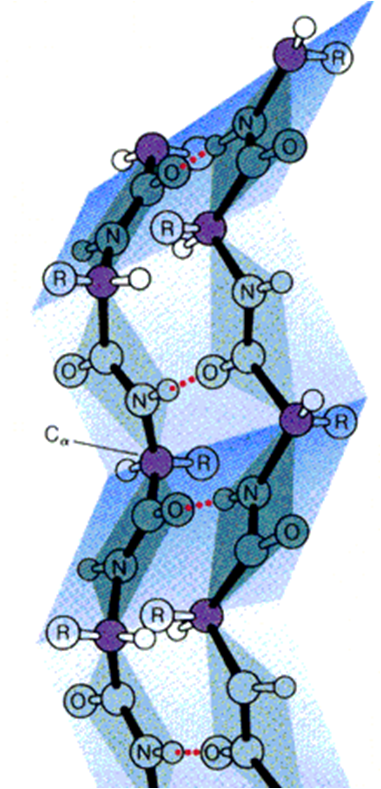
★氨基与羰基形成链间氢键
★侧链伸向片层的上下方
★是一种肽链最伸展的构象
★较小的侧链基团使肽链间能够相互靠近,有
利于 β-折叠的形成
丝心蛋白的结构

3.转角

★多肽链中出现的回折,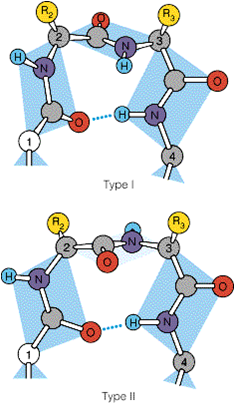 由四个氨基酸组成
由四个氨基酸组成
★AA1羧基与AA4氨基间 形成氢键
★转角常出现在蛋白分子的表面,亲水性强
★转角经常出现修饰


