酶促反应的机制
上一节
下一节
二、酶促反应的机制
★在酶促反应中,酶首先与底物形成复合物,成为过渡态,然后释放出产物,酶分子恢复到原始形态
E+S → ES → E+P
★ES 为酶-底物复合物
锁钥学说与诱导契合学说
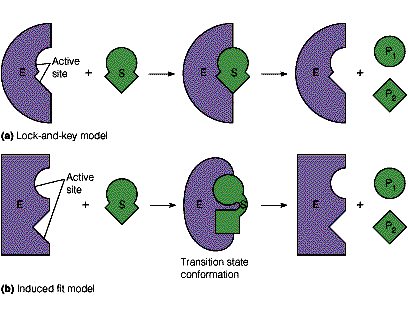
★锁钥学说:酶与底物具有结构上的互补性,能够发生特异性的结合
★诱导契合学说:酶与底物发生结合时相互诱导而发生结构改变
★底物结构的改变产生分子内张力,处于能量较高的过渡态
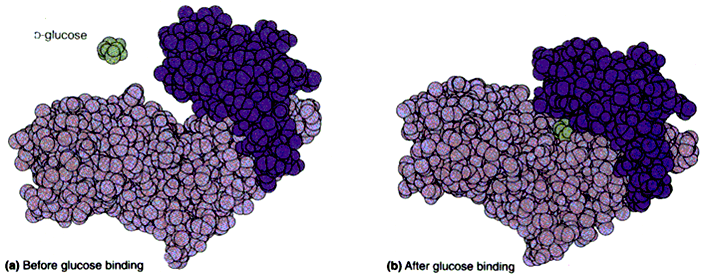
己糖激酶的诱导契合
邻近效应与定向效应
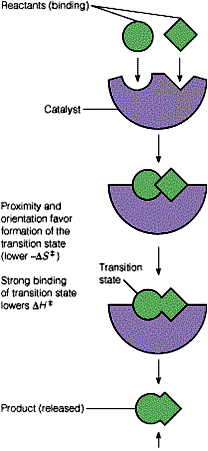
★酶与底物的结合使底物间或底物与催化基团间相互接近,有效浓度达到最大
★在底物间相互接近时,取向也起重要作用
★据估算,邻近效应与定向效应均可使反应速度提高 104 倍
酸碱催化
★催化基团从底物接受质子或向底物提供质子,就是广义的酸碱催化
★羧基、氨基、羟基、巯基、咪唑基等均可进行广义酸碱催化
·咪唑基在生理 pH 条件下处于解离的平衡态,即可作为质子的供体也可作为受体,因此在酸碱催化中占有重要地位
★酸碱催化可以使反应速度提供 10²-105 倍
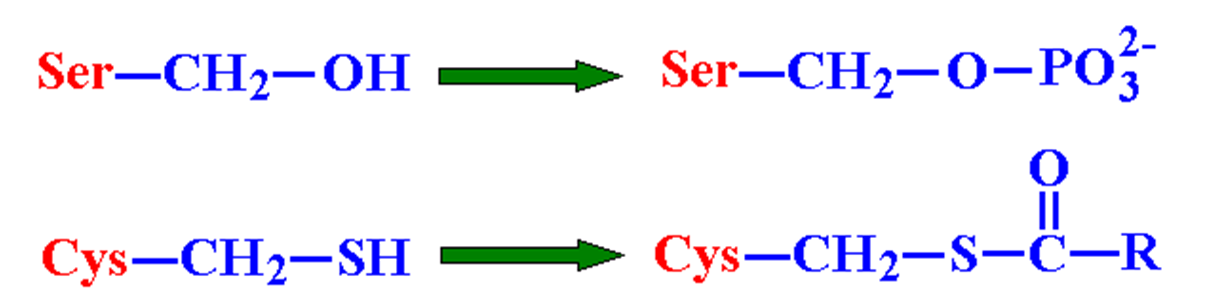
共价催化
★催化基团释放或接受电子,与底物形成不稳定的共价中间体
★Ser 的羟基、Cys 的巯基、His 的咪唑基是常见的亲核基团,可结合酰基、磷酸基等基团
活性部位的微环境
★酶的活性中心往往处于酶分子的疏水性裂缝中,可排除水分子对反应的干扰
★在非极性环境中,两个带电基团间的相互作用要高于在极性环境
★疏水环境有利于酶的催化作用


