二、 底物浓度对反应速度的影响
★在无催化剂时,反应速度(V)与底物浓度([S])为线性关系
★在酶促反应中则存在明显的底物饱和现象:
· 底物浓度较低时存在线性关系
· 在底物浓度较高时反应速度增加缓慢
· 继续增加底物浓度,反应速度达到最大值(Vmax)
(一)中间产物学说与米氏方程
★中间产物学说:酶与底物形成复合物,再分解为产物和游离的酶

·ES 生成迅速,且可逆
·产物的生成较慢,且不可逆
·ES 的浓度决定其分解为产物的速度,决定了酶促反应的速度
推导酶促反应动力学方程式的前提
★ 反应是单一底物反应
★酶促反应速度为初速度,不考虑底物的消耗
★底物浓度远大于酶浓度
★在反应处于稳态时,ES 生成与分解速度相当
米氏方程

★早在 1913 年,由 Michaelis 和 Menten 提出的酶促反应动力学方程,又称米氏方程或米曼氏方程
★Km 为米氏常数(Michaelis constant)

(二)米氏方程可解释底物饱和效应

★反应速度与底物浓度呈双曲线关系
★底物浓度很低时 ( [S] 远小于 Km ),反应速度正比于底物浓度
★当底物浓度很高时( [S] 远大于 Km ), 反应速度达到最大值而不再上升
(三)米氏常数的意义


★根据米氏方程,当 V=Vmax/2 时,Km=[S],即 Km 是反应速度达到 Vmax 一半时的底物浓度
★Km 近似于 ES 复合物的解离常数,可表示酶与底物亲和力的高低,1/Km 与亲和力成正比
米氏常数的意义
★根据:
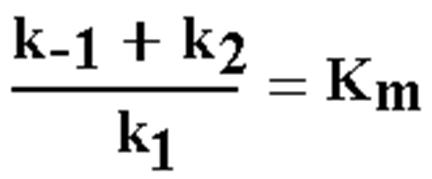
★当 ES 分解为反应的限速步骤时,k2<< k-1 时:
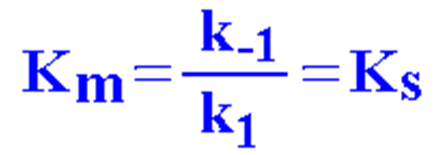
米氏常数的意义
★Km 是酶的特征性常数,与酶和底物的浓度无关,但受到环境条件的影响
★不同的酶 Km 值不同,大致分布范围为 10-6-10-2 mol/L
几种酶米氏常数的比较

米氏常数的意义
★同一种酶对不同的底物具有不同的 Km 值,在酶作用于多底物时,每一底物均有其 Km 值
★当一种酶作用于多种底物时,Km 值最小的底物是最适底物
·最适底物往往就是天然底物
Vmax 的意义
![]()
★Vmax 是酶完全被底物饱和时的反应速度
★Vmax 与酶浓度成正比,受到环境条件的影响
★在一种酶具有多种底物时,对于不同底物有不同的 Vmax
★k2 称转换数,酶被底物饱和后单位时间内每个酶分子催化底物转化为产物的分子数,转换数也是酶的特征性常数


