3.2Modification of advanced structure(高级结构加工)
★a. Folding of newly formed peptide chain——新生肽链折叠
★b. Subunit polymerization (obtaining function)——亚基聚合
★c. Coenzyme connection(glycoprotein,lipoprotein,conjugated enzyme)—辅酶连接
a. Polypeptide chainfolds into natural conformation
——新生肽链折叠
★Correct secondary structure, motif, domain and final conformation are formed stepwisely.(形成正确的空间结构)
★Primarystructure is the basis of advanced structure(蛋白一级结构为基础)
★In thepresent of accesarymolecules: enzyme or chaperon.(分子伴侣为辅助)
Molecules involved innewly polypeptide folding

★ 1. 分子伴侣 (molecular chaperon)
★ 2. 蛋白二硫键异构酶 (protein disulfide isomerase, PDI)
★3. 肽-脯氨酰顺反异构酶(peptide prolylcis-trans isomerase, PPI)
·Molecular chaperon (分子伴侣)
★Molecular chaperones are proteins that assist the non-covalent folding/unfolding and assembly/disassembly of othermacromolecular structures, but do not occur in these structures when thestructures are performing their normal biological functions having completedthe processes of folding and/or assembly.
分子伴侣是细胞一类保守蛋白质,促进各功能域和整体蛋白质的正确折叠。
★1. 热休克蛋白(heat shock protein, HSP)
HSP70, HSP40 and HSP90 family
★2. 伴侣素(chaperonins)
Prokaryote: GroEL(eu: HSP60)and GroES(HSP10) family
★HSP 作为分子伴侣的作用机制
·HSP70 辅助蛋白质折叠-通过与疏水片段的结合和解聚.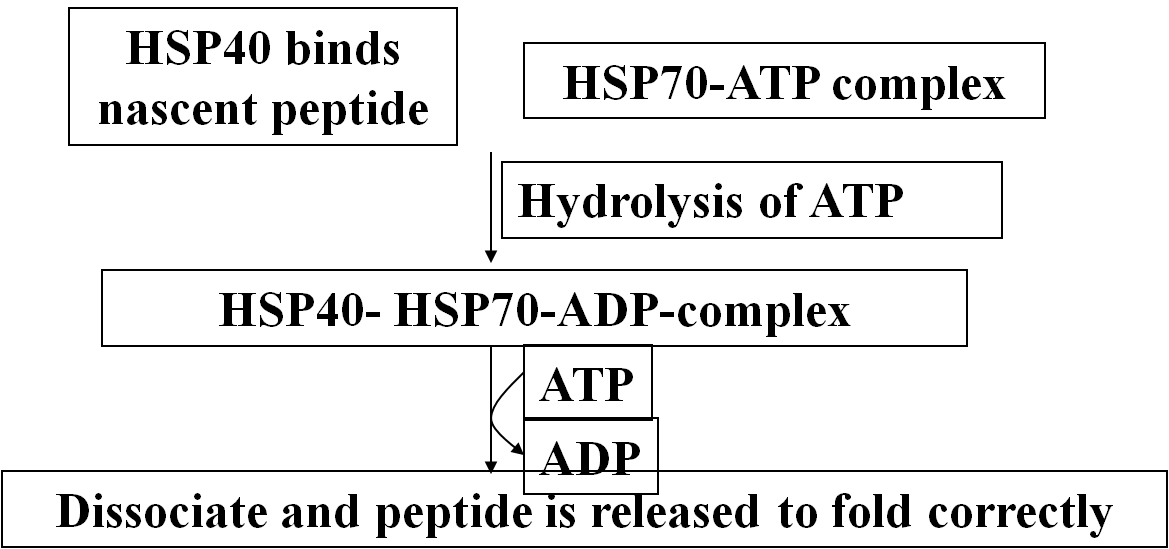
· 防止新生肽链聚集和错误折叠- inhibit “off path-way” folds.
★Chaperonin(伴侣素)——Providing a microenvironment for protein to fold
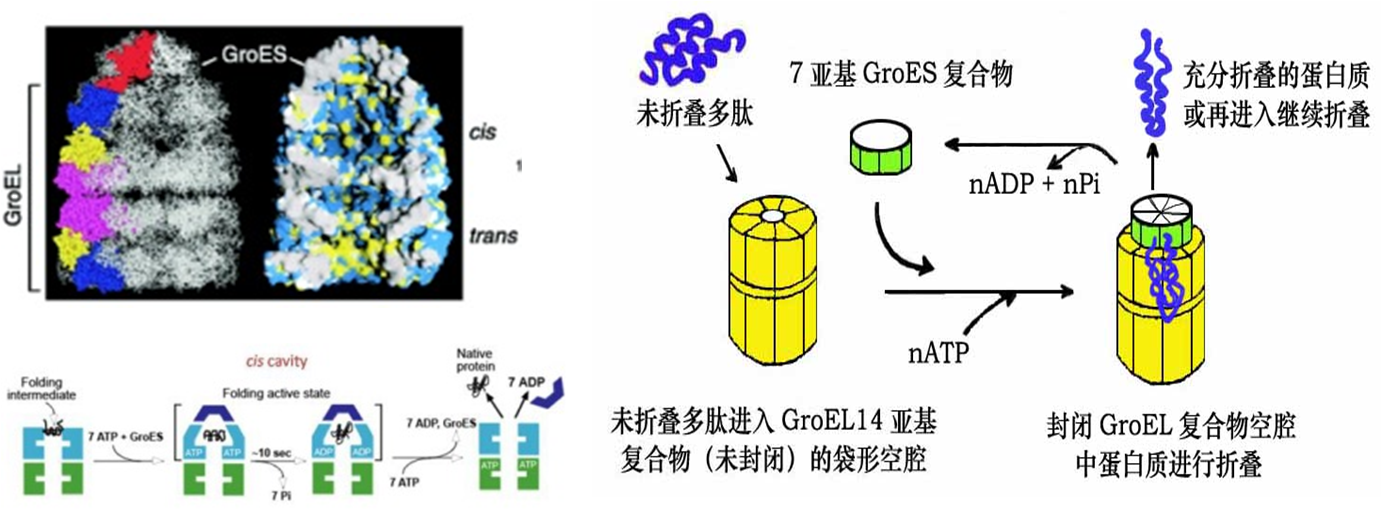
Protein folding after translation
·Protein disulfide isomerase(蛋白二硫键异构酶 )
★Protein disulfide isomerase is an enzyme in the endoplasmic reticulum in eukaryotes that catalyzes the formation and breakage of disulfide bonds between cysteine residues within proteins as they fold.This allows proteins to quickly find the correct arrangement of disulfide bonds in their fully folded state.
可在较大区段肽链中催化错配二硫键断裂并形成正确二硫键连接,最终使蛋白质形成热力学最稳定的天然构象。
·Prolyl isomerase(肽-脯氨酰顺反异构酶 )
★多肽链中肽酰-脯氨酸间形成的肽键有顺反两种异构体,空间构象明显差别。
Prolyl isomerase is an enzyme found in both prokaryotes and eukaryotes that interconverts the cis and trans isomers of peptide bonds with the amino acid proline.
肽酰-脯氨酰顺反异构酶是蛋白质三维构象形成的限速酶,在肽链合成需形成顺式构型时,可使多肽在各脯氨酸弯折处形成准确折叠。
★Properties of chaperon(分子伴侣特点)
1. There is no specificity to nascent polypeptide chain
(无肽链特异性)
2. Coupled with hydrolysis of ATP(伴随ATP水解)
3. Contain no information about particular folding patterns.(无折叠信息)
4. Multiple functions.(多功能)
5. Conserved in primary sequence.(一级结构保守)


