在学习本节课之前,先来看一段好玩的有机分子舞蹈
(日语配音,视频来自网络,版权归原作者所有)
本节重点内容提示
1、元素的电负性
2、酸碱概念
3、电子流动
4、取代反应的机理
一、引言

合成化学是一门研究物质合成和合成方法的科学,它包含了无机、有机、高分子等各种物质的合成。
它是化学学科的基础和核心,是人类认识物质和创造物质的重要途径和手段。
建议国家教育和科学研究机构在组织化学教育活动中淡化原化学二级学科,在组织科研活动中按照科学问题引导。
二、概述
1、元素电负性
电负性(简写 EN)(electronegativity),也译作电负度、负电性及阴电性,是综合考虑了电离能和电子亲合能,首先由莱纳斯·鲍林于1932年提出。它以一组数值的相对大小表示元素原子在分子中对成键电子的吸引能力,称为相对电负性,简称电负性。元素电负性数值越大,原子在形成化学键时对成键电子的吸引力越强。
(1)判断元素的金属性和非金属性。一般认为,电负性大于1.8的是非金属元素,小于1.8的是金属元素,在1.8左右的元素既有金属性又有非金属性。
(2)判断化合物中元素化合价的正负。电负性数值小的元素在化合物吸引电子的能力弱,元素的化合价为正值;电负性大的元素在化合物中吸引电子的能力强,元素的化合价为负值。
(3)判断分子的极性和键型。电负性相同的非金属元素化合形成化合物时,形成非极性共价键,其分子都是非极性分子;电负性差值小于1.7的两种元素的原子之间形成极性共价键,相应的化合物是共价化合物;电负性差值大于1.7的两种元素化合时,形成离子键,相应的化合物为离子化合物。

由于分子内成键原子的电负性不同,而引起分子内电子云密度分布不均匀。这种影响沿分子链键静电诱导地传递下去,这种电子效应——诱导效应((Inductive effect))
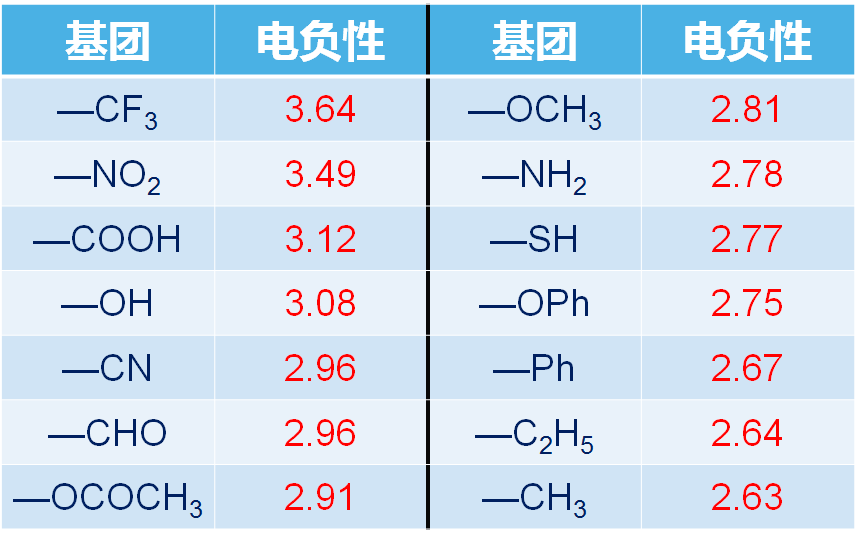
常见的基团电负性
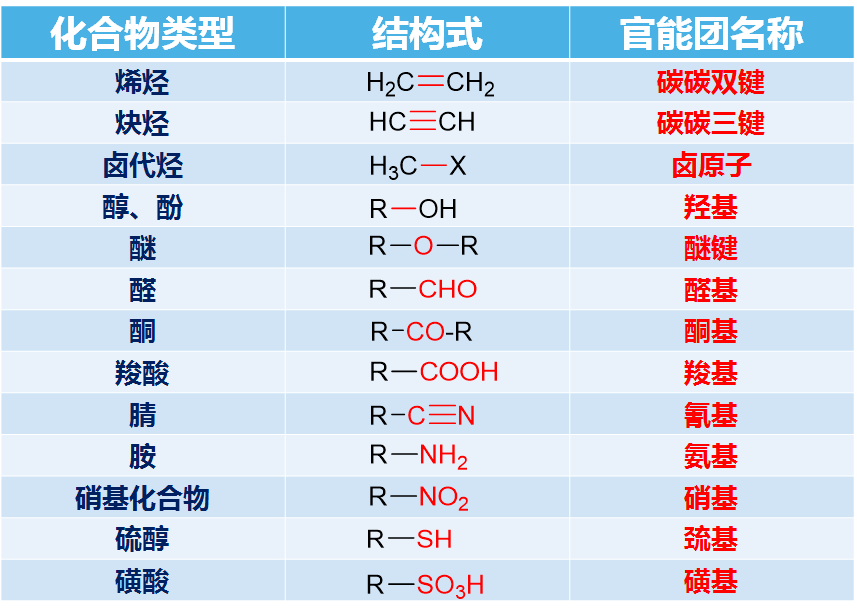
2、常见的重要官能团
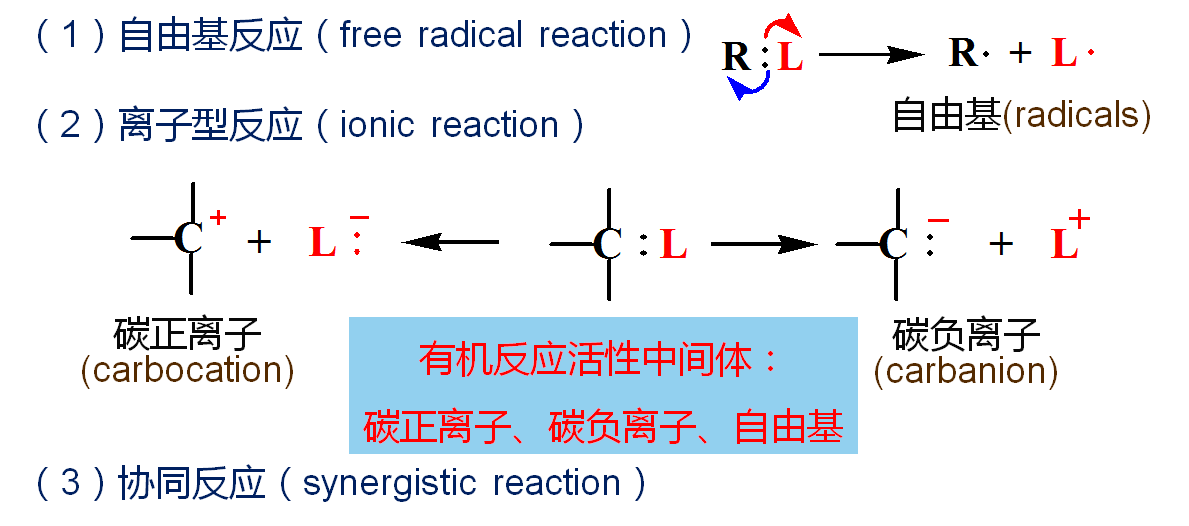
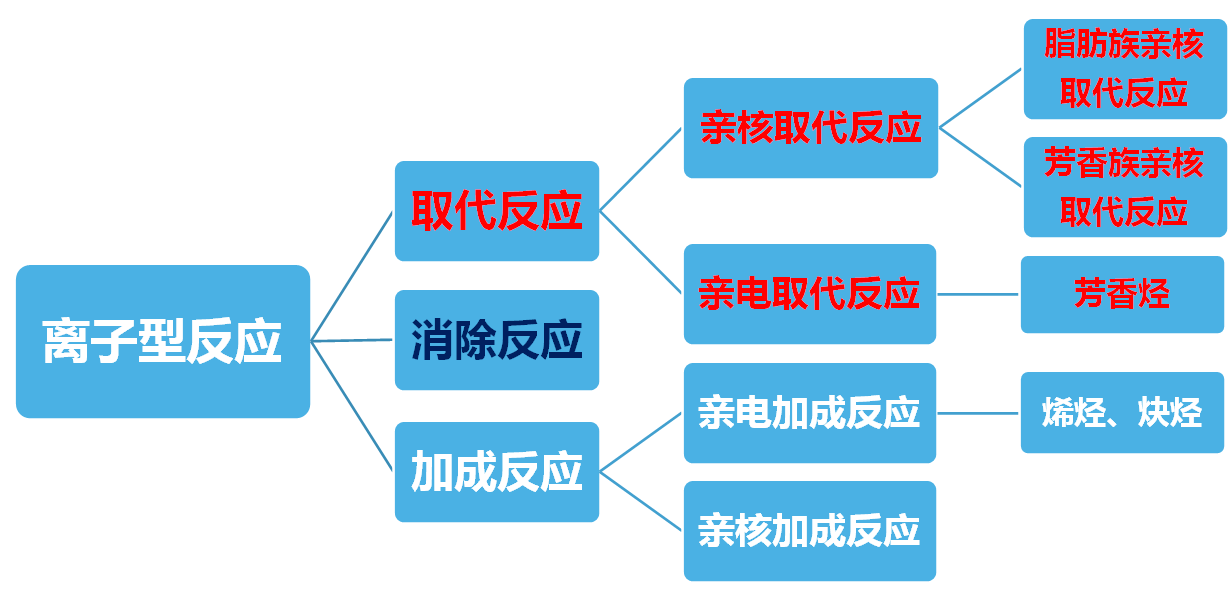
3、有机化学反应类型
4、酸碱的概念
(1)Arrhenius 电离理论
(2)Brønsted酸碱理论
酸:给出质子的分子或离子
碱:接受质子的分子或离子
(3)Lewis酸碱理论(重点学习内容)
Lewis 酸(Lewis acids):能够接受未共用电子对的分子或离子
Lewis 碱(Lewis bases):能够给出电子对的分子或离子
思考:你觉得烯烃和苯环属于酸还是碱?
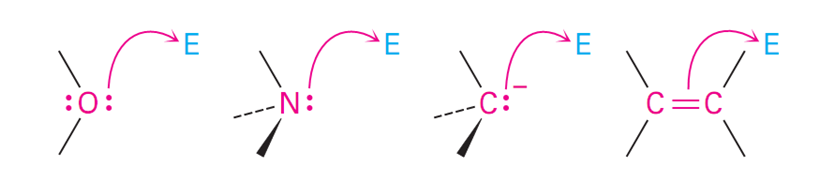
5、电子流动(electron transfer)
电子流动规则:
电子从亲核试剂流出(Electrons usually flow from one of these nucleophiles)
电子流入到亲电试剂(Electrons usually flow to one of these eletrophiles)
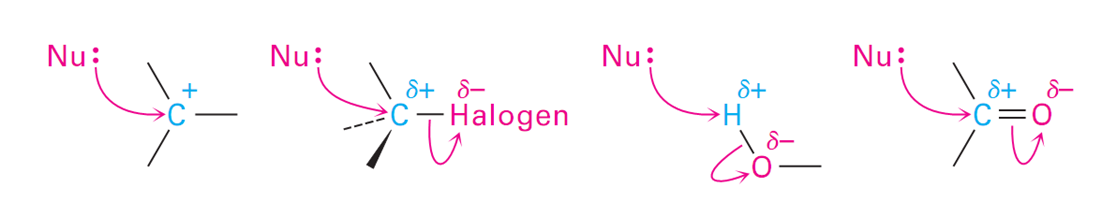
关于画电子流动的视频,视频的方向可能有点问题
如果感觉太快了,可以减慢速度播放
三、取代反应
包括亲核取代反应和亲电取代反应
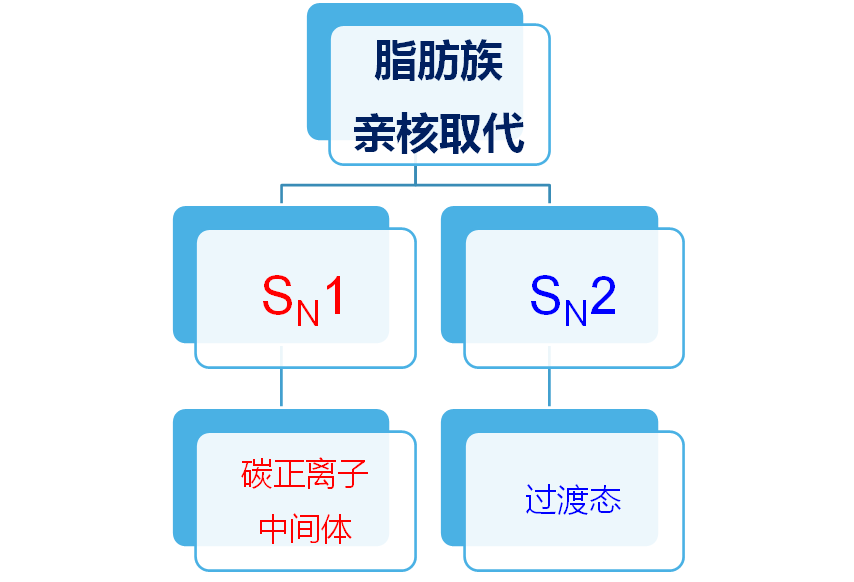
1、脂肪族亲核取代反应
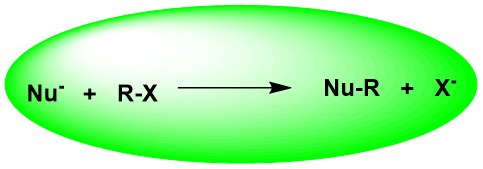
脂肪族亲核取代反应占有重要的地位,研究的也较为深入。
与不同的亲核试剂反应,生成多种重要官能团。
脂肪族亲核取代反应(SN2)
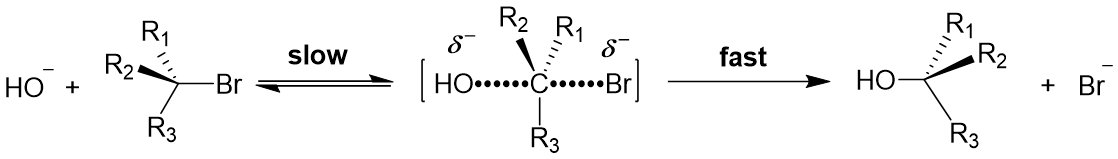
反应速率 = k [RBr] [HO-]
底物结构:空间效应;位阻越大,反应越慢
亲核试剂:碱性和可极化性,I- > Br-> Cl-
离去基团:RSO3- > I- > Br- > Cl- > RCOO- > -OH > -NH2
思考:
亲核试剂亲核性强弱的一般性规律。
什么是可极化性?
脂肪族亲核取代反应(SN1)
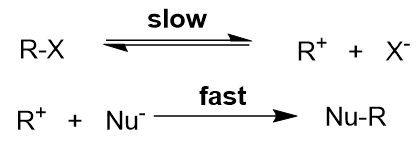
反应速率 = k [RX]
底物结构: 烯丙基卤代烷 ≈ 苄基卤代烷 > 叔卤代烷 > 仲卤代烷 > 伯卤代烷
离去基团:RSO3- > I- > Br- > Cl- > RCOO- > -OH > -NH2
2、芳香族亲核取代反应(SNAr)
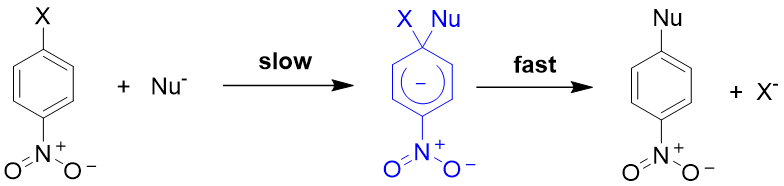
双分子反应,取决于进攻试剂的亲核性和芳香化合物的亲电性
邻对位有吸电子基团加速反应进行
加成-消除机理
关于苯炔反应机理的视频,视频的方向可能有点问题
如果感觉太快了,可以减慢速度播放
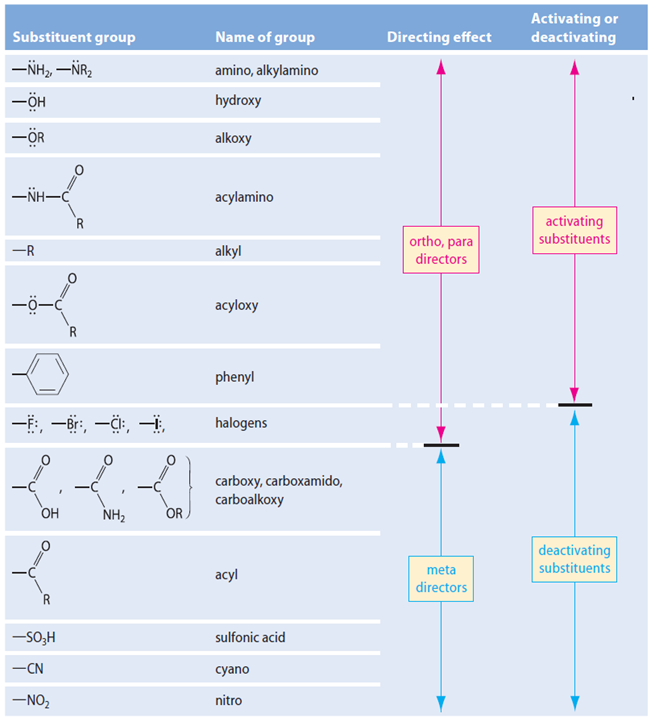
3、芳香族亲电取代反应
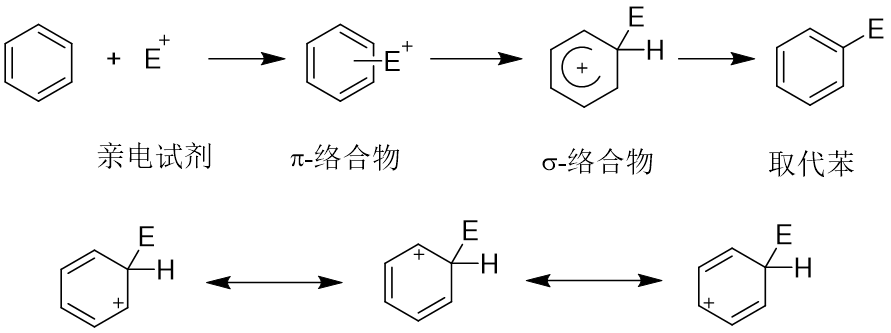
定位规律:
给电子共轭效应的基团总是第一类定位基(邻对位定位基);
吸电子共轭效应的基团总是第二类定位基(间位定位基)
附件:教材章节扫描版(为了方便大家阅读,这个文档只有第2章,34页)
附件:第1讲课件


