工程材料通常是固态物质,是由各种元素通过原子、离子或分子结合而成的。原子、离子或分子之间的结合力称为结合键。根据结合力的强弱,可把结合键分为强键(离子键、共价键、金属键)和弱键(即分子键)两类。
一、离子键
当周期表中相隔较远的正电性元素原子和负电性元素原子相互接近时,正电性原子失去外层电子变为正离子, 负电性原子获得电子变为负离子。正负离子通过静电引力互相吸引,当引力与离子间的斥力相等时便形成稳定的离子键。图2-1为钠原子与氯原子形成离子键的过程。离子键结合力大,因而通过离子键结合的材料强度高、硬度高、熔点高、脆性大。由于离子难以移动输送电荷,所以这类材料都是良好的绝缘体。离子的外层电子由于被牢固束缚,难于被光激发,所以离子材料不能吸收可见光,是无色透明的。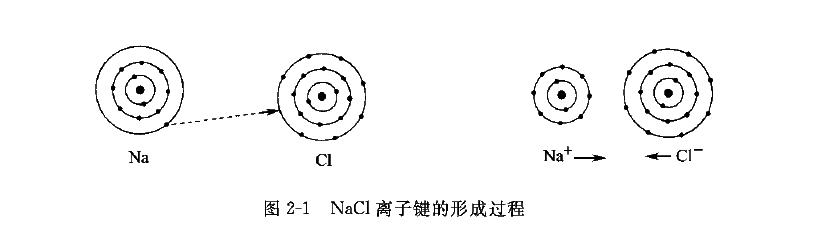
二、共价键
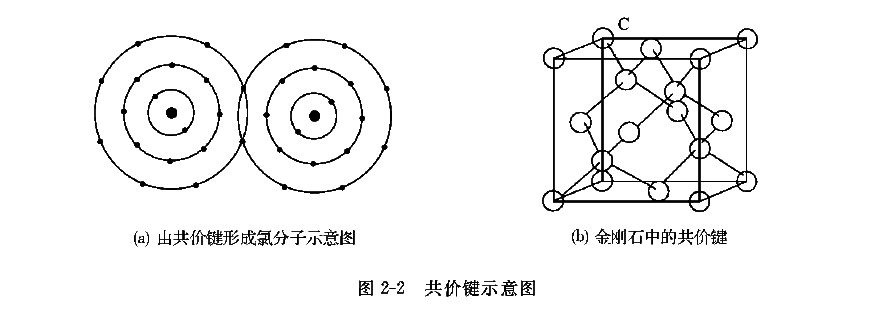
周期表中ⅢA~ⅦA族同种元素的原子或电负性相差不大的异种元素原子相互接近时,不可能通过电子转移来获得稳定的外层电子结构,但可以通过共用电子来达到这一目的。图2-2a为两个氯原子通过共用一个电子对形成氯分子的示意图。这种通过共用电子对而形成的结合键称为共价键。共价键中的电子对数因元素种类不同而不同,如氮分子中存在五个电子对。一个原子也可以与几个原子同时共用外层电子,如金刚石中的一个碳原子与周围的四个碳原子各形成一个电子对(见图2-2b)。通过共价键结合的材料同样具有强度高、熔点高、脆性大的特点。其导电性依共价键的强弱而不同,弱共价键的锡是导体,硅是半导体,而金刚石则是绝缘体。具有离子键和共价键的工程材料多为陶瓷或高分子聚合物。
三、金属键
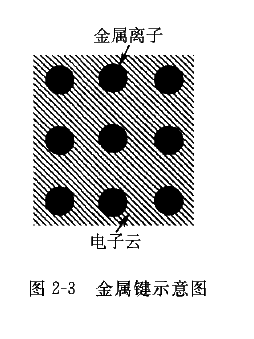 金属原子的外层电子少,很容易失去。因此金属原子之间不可能通过电子转移或共用来获得稳定的外层电子结构。当金属原子相互靠近时,其外层电子脱离原子,成为自由电子, 而金属原子则成为正离子,自由电子在正离子之间自由运动,为各原子所共有,形成电子云或电子气。金属离子通过正离子和自由电子之间引力而相互结合,这种结合键称为金属键,如图2-3所示。自由电子的存在使金属具有良好的导电性和导热性,并使金属不透明并呈特有的金属光泽。金属键无方向性,当金属原子间发生相对位移时,金属键不受破坏,因而金属塑性好。
金属原子的外层电子少,很容易失去。因此金属原子之间不可能通过电子转移或共用来获得稳定的外层电子结构。当金属原子相互靠近时,其外层电子脱离原子,成为自由电子, 而金属原子则成为正离子,自由电子在正离子之间自由运动,为各原子所共有,形成电子云或电子气。金属离子通过正离子和自由电子之间引力而相互结合,这种结合键称为金属键,如图2-3所示。自由电子的存在使金属具有良好的导电性和导热性,并使金属不透明并呈特有的金属光泽。金属键无方向性,当金属原子间发生相对位移时,金属键不受破坏,因而金属塑性好。
四、分子键
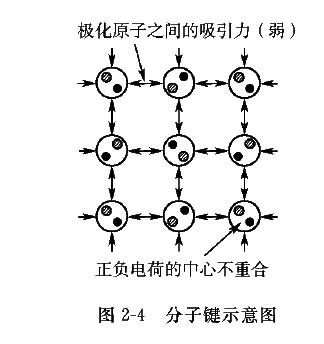 在某些分子中可能存在偶极矩,这是由于分子中共价电子的非对称分布,使分子的某一部分比其他部分更偏于带正电或带负电(称为极化)。一个分子的带正电部分会吸引另一个分子的带负电部分,这种结合力称为范德瓦尔斯力或分子键,如图2-4所示。分子键也可以产生于电子随机运动引起的瞬间极化。
在某些分子中可能存在偶极矩,这是由于分子中共价电子的非对称分布,使分子的某一部分比其他部分更偏于带正电或带负电(称为极化)。一个分子的带正电部分会吸引另一个分子的带负电部分,这种结合力称为范德瓦尔斯力或分子键,如图2-4所示。分子键也可以产生于电子随机运动引起的瞬间极化。
当氢原子与一个电负性很强的原子结合成分子时,氢原子的唯一一个电子会向另一个原子强烈偏移,氢离子几乎成为一个带正电的核,可以对第三个电负性较大的原子产生较强的吸引力,使氢原子在两个电负性很强的原子之间形成一个桥梁,这种结合力称为氢键或氢桥。氢键在生物系统起着要重作用,但和所有的弱键一样,在工程上的重要性并不显著。


