流式细胞仪常见应用

检测细胞凋亡-annexinV/PI双染色法
正常细胞膜的磷脂分布是不对称的,活细胞中林芝酰丝氨酸(phosphatidylserine,PS)位于细胞膜的内表面。
细胞凋亡时细胞膜发生变化,这种极化现象消失,PS均匀分布于细胞膜的内表面和外表面。
annexin V是一种对PS有高度亲和力的,钙依赖性的磷脂结合蛋白,annexin V可以特异性地识别凋亡细胞表面的PS。
活细胞的PS位于细胞膜的内表面,无法与 annexin V特异性结合。所以可以用FITC偶联的annexin V 鉴别凋亡细胞和活细胞。
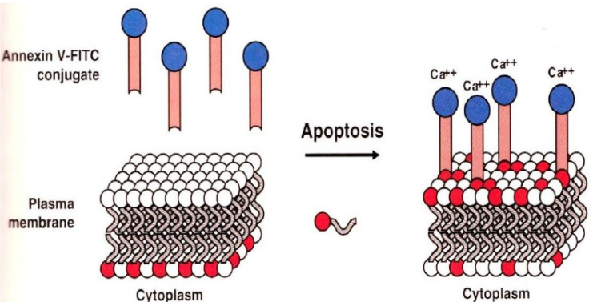
PI染料能够通过坏死细胞的细胞膜与细胞内的DNA结合,能够区分坏死细胞和活细胞,所以annexin V 和PI同时使用,就可以区分活细胞,凋亡细胞和坏死细胞。
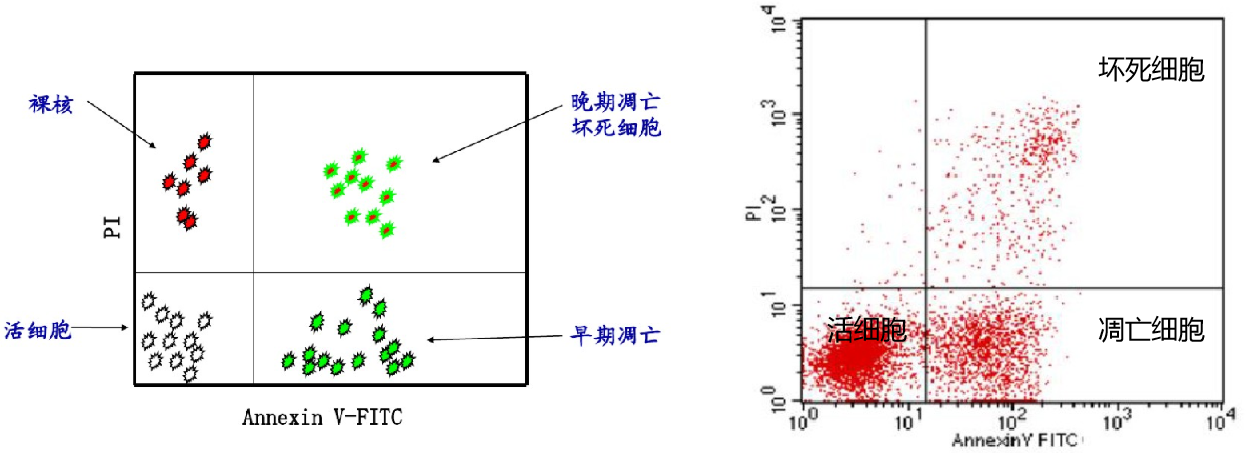
处理方法:
标记方法与常规标记荧光抗体的方法一样,加入适量的FITC-annexin V和PI,4℃静置30min即可。
注意标记PI的方法与PI染色检测细胞内DNA含量的方法不同,不许提前固定细胞,因为本方法标记PI是为了检测细胞膜的通透性从而鉴别细胞是活细胞还是死细胞,而用PI检测DNA含量时必须先破坏活细胞的细胞膜的完整性使PI进入细胞内与DNA结合。
检测细胞周期
细胞周期就是从细胞分裂产生的信息报生长开始到下一次细胞分裂形成子细胞结束位置所经历的过程,主要分为G0期,G1期,S期,G2期和M期。
G0期细胞是指处于相对静止时期的细胞,细胞暂时不参与细胞的增值而执行一定的生物学功能,所以细胞是二倍体,含有而被体量的DNA。
G1期即DNA合成前期,此时细胞为下一次有丝分裂准备DNA合成所需要各种物质和能量等,细胞仍未二倍体。
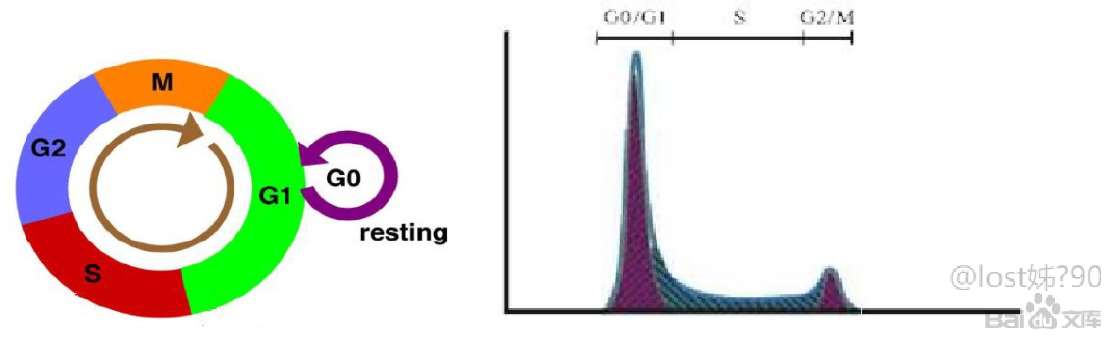
S期即DNA合成期,此期是细胞周期中的关键时期,DNA的量经过复制增加已被,所以S期细胞内的DNA处于二倍体量到四倍体量的连续增加过程。
G2期即DNA合成后期,此时DNA合成已经完成,为下一步忧思分裂做准备,细胞为四倍体。
M期即为细胞分裂期,在分裂完成前细胞仍未四倍体。
非特异性核酸荧光染料标记法
处于不同细胞周期的细胞DNA含量不同,处于G0和G1起的细胞含有两倍体量的DNA,处于S期的细胞含有从两倍体量至四倍体两的DNA,处于G2和M期的细胞含有四倍体量的DNA。
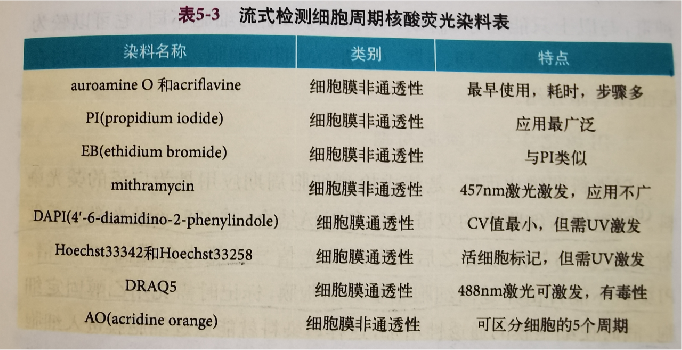
利用非特异性核算荧光染料与细胞内的DNA结合,通过流式检测就能反应细胞内DNA的含量,区分细胞周期的G0/1期,S期和G2/M期。
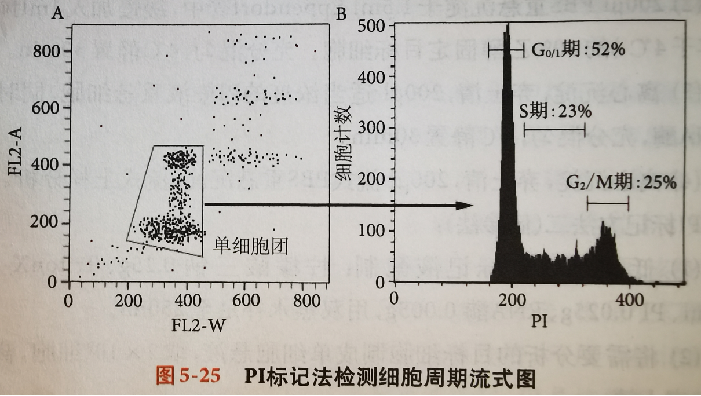
PI标记法检测细胞周期
PI能够与细胞内的双链DNA和RNA结合,被488nm激光击发后发射荧光,与核酸结合之后其发射荧光信号的能力会提高20-30倍。
PI染料不能自由穿过活细胞完整的细胞膜,标记时需先用乙醇固定细胞。
同时加入RNA酶消化细胞内的RNA,使PI只能与细胞内的DNA 结合,反应细胞内DNA的含量,继而通过细胞内DNA的含量确定细胞周期。
样品处理
将需要分析的目标细胞制成单细胞悬液,取2X106细胞,离心沉淀,弃上清。
200μl PBS重悬沉淀于1.5ml Eppendorf管中,缓慢加入1ml预冷(保存于4℃)的70%乙醇固定目标细胞。充分混匀,4℃静置30min。
离心沉淀,弃上清,200μl适当浓度的PI染液重悬细胞,同时加入RNA酶,充分混匀,4℃静置30min。
离心沉淀,弃上清,200μl流式PBS重悬沉淀,流式上样分析。
注意事项
实际样品中经常会出现粘连的双细胞和多细胞团体,而流式细胞仪可能会将粘连在一起的两个二倍体细胞当作是一个四倍体的细胞,如果粘连的细胞较多而没有在分析时排除,得到的流式结果就不准确。
在检测细胞内DNA含量时应尽量排除粘连的双细胞和多细胞团体的影响。
样品处理过程中可以适当加入EDTA,尽量减少细胞之间的粘连。
在流式上样前用40μm的滤网过滤,除去较大的多细胞团体。
流式分析时尽量降低上样速度,尽量避免流式细胞仪将两个相邻的细胞当做一个细胞分析。
流式分析时先在FSC-SSC物理图上圈定目标细胞群,排除多细胞团块的影响。
以FL2接收PI荧光信号检测细胞内DNA含量为例:
检测基因表达-GFP报告基因系统
在具有活性的单细胞水平检测基因表达对于研究细胞的功能非常重要,流式细胞术能够检测单细胞水平上的基因表达,并根据基因表达的情况分选出不同的单细胞克隆。
绿色荧光蛋白(green fluorescent protein,GFP)是从水母 aequorea victoria 中提取的一种有内在荧光基团(internal fluorophore)的蛋白质,被488nm激光激发后能够产生507nm的荧光,编码该蛋白质的基因是常用的报告基因。
流式检测细胞目标基因的表达情况时,只需将编码GFP的基因整合到目标基因的启动子后面,当目标基因表达时也会同时表达GFP基因,细胞内GFP量与目标基因的表达强弱成正比。
GFP报告基因系统的优缺点:
优点:
GFP报告基因系统只需将编码GFP的基因整合到目标基因的启动子后面即可,表达的GFP内含荧光基团,能够直接产生荧光,不需要将底物导入细胞内,步骤简单,对细胞的刺激也相对较小。
GFP报告基因系统结果准确,避免了酶-底物系统的复杂性,也避免了底物非特异性催化导致的假阳性结果。
缺点:GFP的荧光信号较弱,又缺少了酶-底物系统的信号放大作用,所以GFP报告基因系统的敏感性很低,一个细胞内至少需要表达50000~100000个GFP分子,其产生的荧光信号才能被流式细胞仪检测到。
解决GFP荧光信号弱的方法之一是改变GFP的蛋白质结构,构造表达强荧光信号的GFP变异体,如GFP(S65T,V163A)变异体和GFP(S202F、T203I、V163A)变异体。


