固态物质按其原子排列规律的不同可分为晶体与非晶体两大类。
原子呈规则排列的物质称为晶体,如金刚石、石墨和固态金属及合金等,晶体具有固定的熔点,呈现规则的外形,并具有各向异性特征;
原子呈不规则排列的物质称为非晶体,如玻璃、松香、沥青、石蜡等,非晶体没有固定的熔点。
在金属晶体中,原子是按一定的几何规律作周期性规则排列。
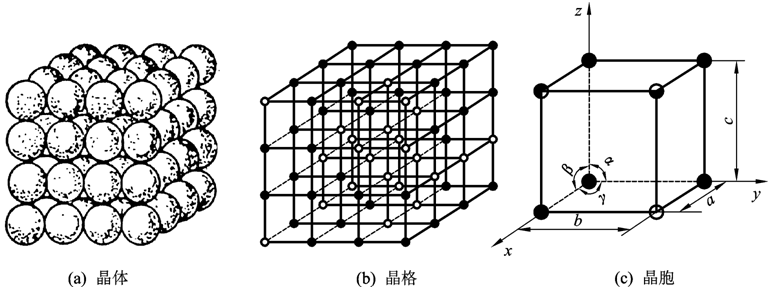
晶体、晶格与晶胞示意图
晶体
物体内部的原子 ( 或分子 ) 在三维空间中 , 按一定规律作周期性排列的固体。
晶体物质所具有的性质:固定的熔点;各向异性等。 例如 , 所有的金属、食盐等。
晶格
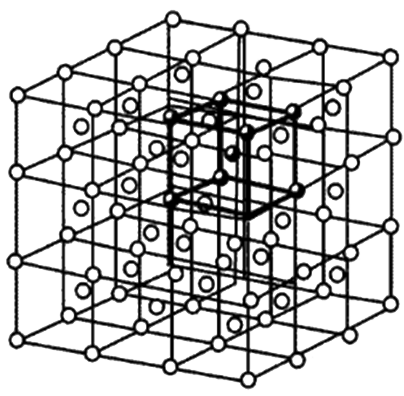
为了研究晶体中原子的排列规律,假定理想晶体中的原子都是固定
不动的刚性球体,并用假想的线条将晶体中各原子中心连接起来,
便形成了一个空间格子,这种抽象的、用于描述原子在晶体中规则
排列方式的空间格子称为晶格。
晶胞
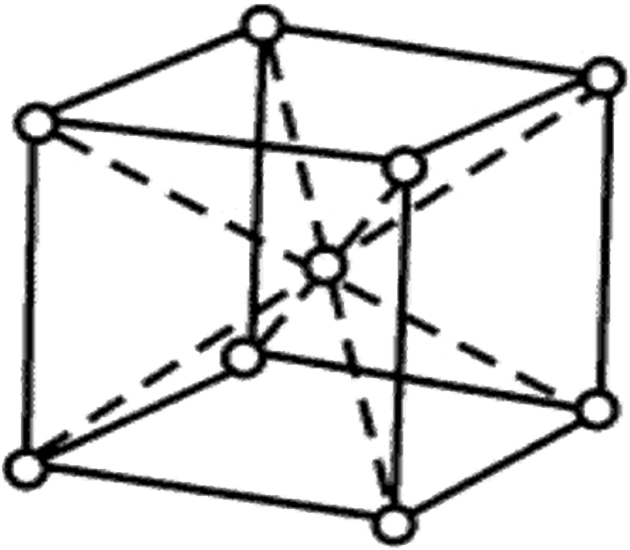
从晶格中选取一个能够完全反映晶格特征的、最小的几何单元来分析晶体中原子的排列规律,这个最小的几何单元称为晶胞。
晶格常数
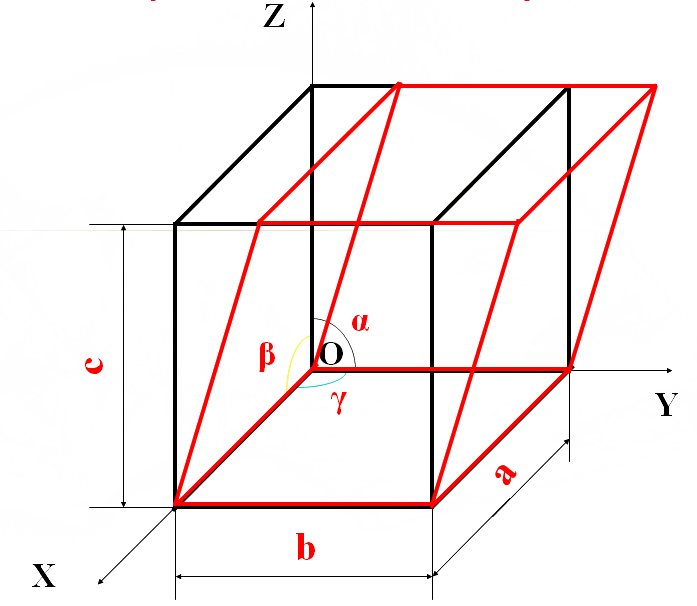
晶胞的大小和形状常以晶胞的棱边长度:a、b、c
及棱边夹角:α、β、γ 来表示
晶胞的棱边长度称为晶格常数,以埃(Å)为单位来表示:
(1Å =10-8cm)
晶格的致密度与配位数
用晶格的致密度表示。晶格的致密度是指晶胞中所含原子的体积与该晶胞的体积之比。
体心立方晶格
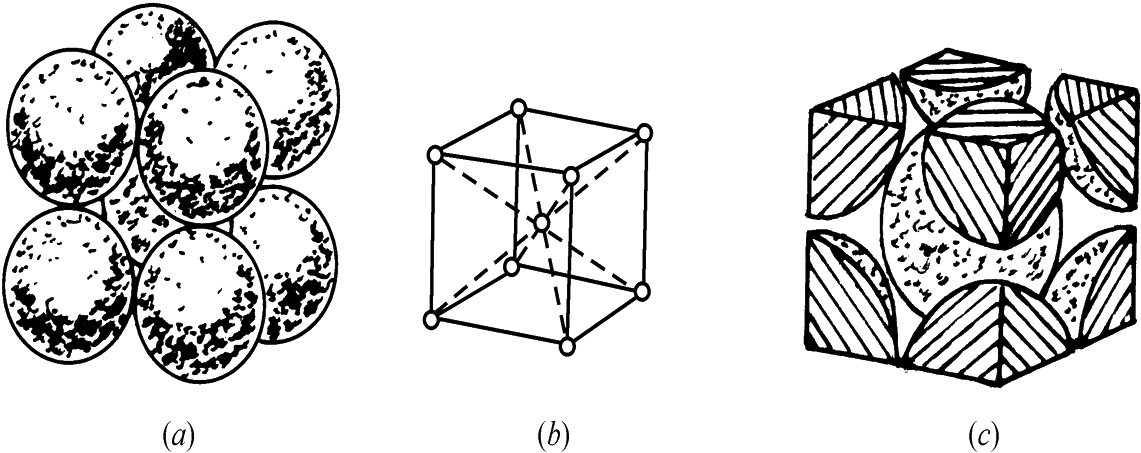
体心立方晶格每个晶胞中实际含有的原子数为(1/8)×8+1=2个。
具有体心立方晶格的金属有:铬(Cr)、钨(W)、钼(Mo)、钒(V)、α铁(α-Fe)等。
面心立方晶格
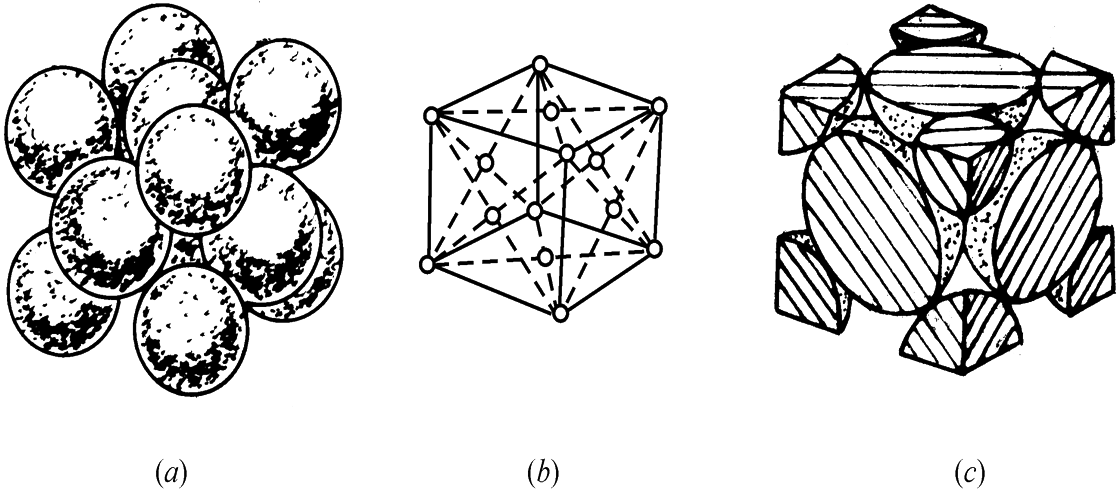
面心立方晶格每个晶胞中实际含有的原子数为(1/8)×8+6×(1/2)=4个。
具有面心立方晶格的金属有:铝(Al)、铜(Cu)、镍(Ni)、金(Au)、银(Ag)、γ铁(γ-Fe)等。
密排六方晶格
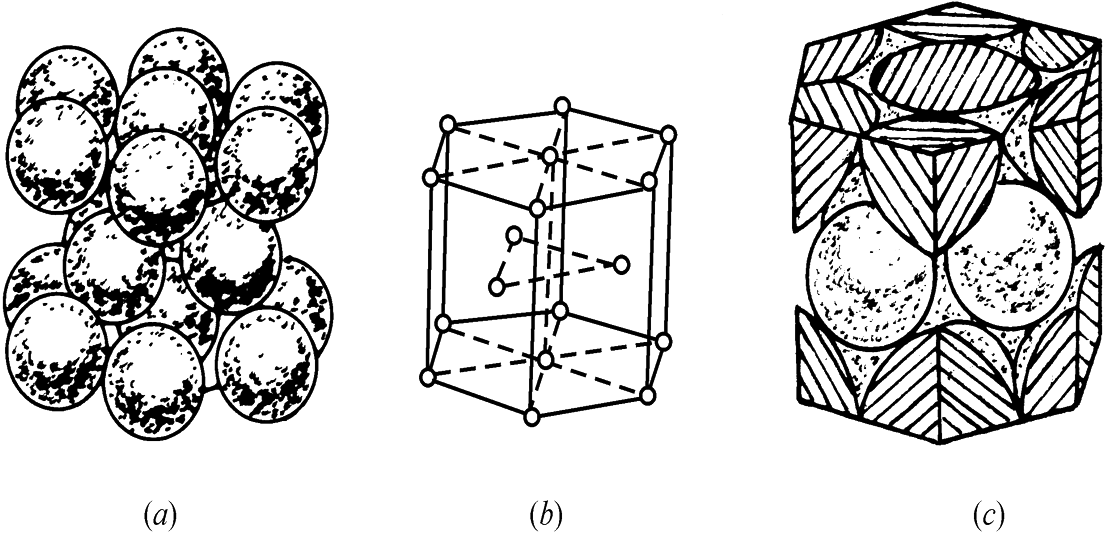
密排六方晶格的晶胞是个正六方柱体,每个晶胞中实际含有的原子数为(1/6)×12+(1/2)×2+3=6个。
具有密排六方晶格的金属有:镁(Mg)、锌(Zn)、铍(Be)等。
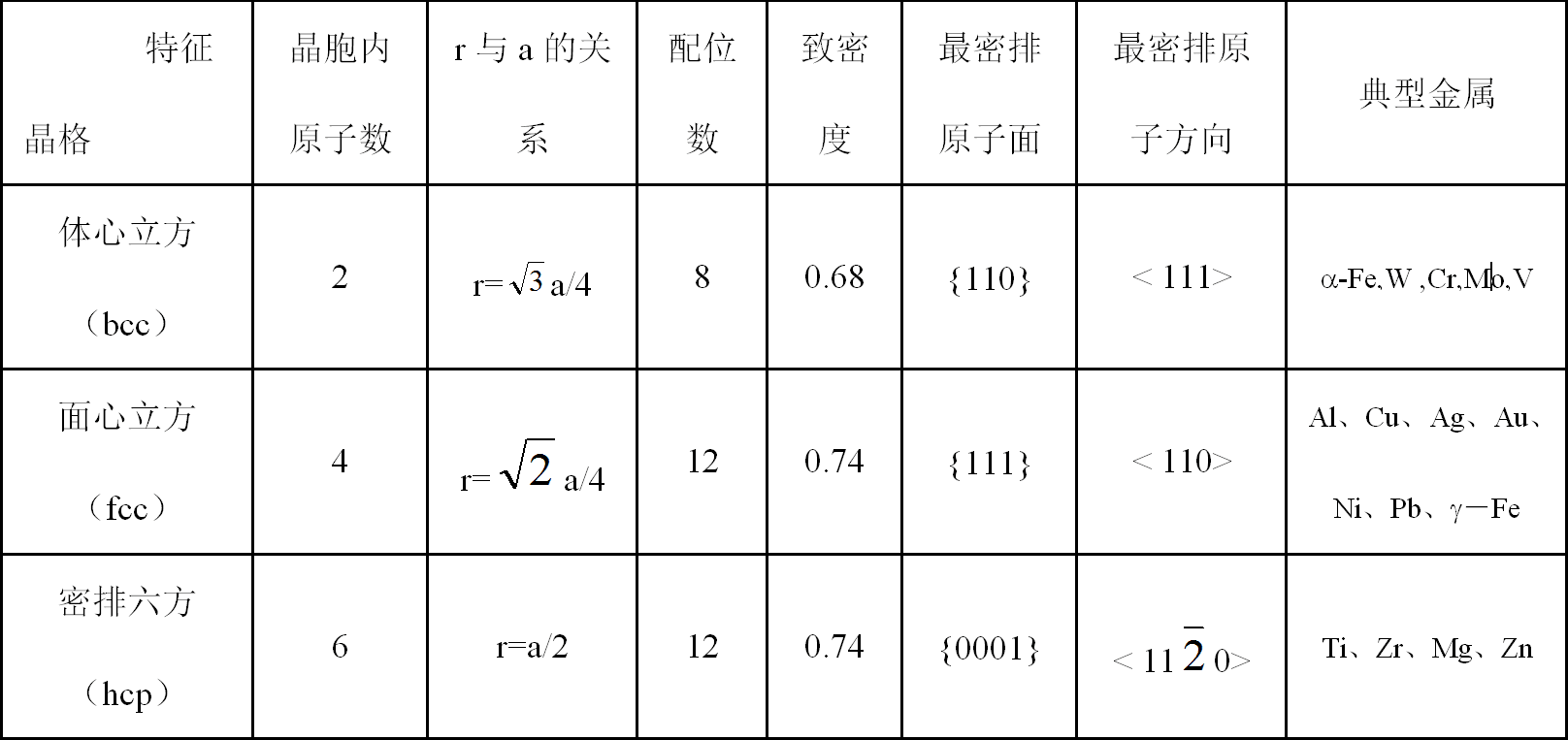
表2.1 三种常见金属晶格的常用数据
晶体结构与材料性能:(一般规律)面心立方的金属塑性最好,体心立方次之,密排六方的金属较差。
参考书目




