

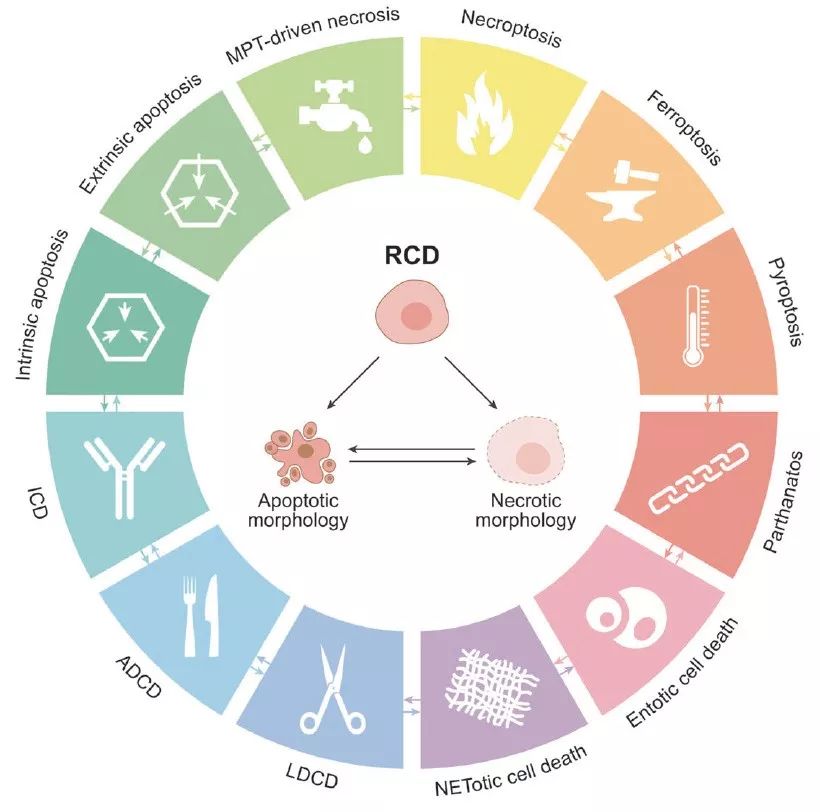
细胞死亡的12种方式
什么是细胞凋亡?
细胞凋亡是由基因控制的,自主的、有序性的死亡, 是受一套程序严密控制的过程,又被称为细胞程序性死亡( programmed cell death,PCD)。
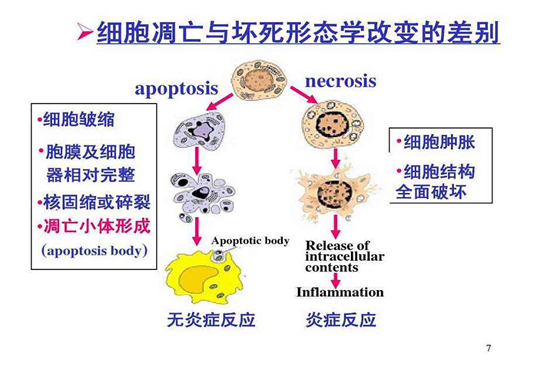
*细胞坏死是细胞在遭受极度刺激时引起的细胞死亡,以细胞质膜的破裂为特征,造成内含物的炎性泄露,是一种非正常死亡。
什么是细胞焦亡?
细胞焦亡(pyroptosis)主要在炎症性细胞死亡中被发现,早期一直被认为是凋亡过程,近年已解析感染或损伤性信号活化焦亡的下游通路。
GSDMD是Gasdermin家族成员,是焦亡的核心效应分子。目前认为GSDMD主要受Caspase-1/4/5/11活化可以在276位Asp进行切割产生活性。近期也有关于其功能的新研究。在中性粒细胞中,GSDMD可以经弹性蛋白酶Elastase水解,介导中性粒细胞发生焦亡。在凋亡通路活化后,GSDMD可经Caspase-3在88位Lys位点发生切割,此时其N端具有活性功能的结构域破坏,丧失了诱导焦亡的功能。而有一些研究也曾发现Caspase-8可参与相关感染免疫通路的调控,但具体机制仍不清。
近日,Science和PNAS杂志相继发表了对耶尔森氏菌Yersina感染引起细胞死亡研究的新成果,分别为马萨诸塞大学医学院的Egil Lien和Katherine A. Fitzgerald课题组发表于Science题为Pathogen blockade of TAK1 triggers caspase-8–dependent cleavage of gasdermin D and cell death和塔夫茨大学医学院Alexander Poltorak发表于PNAS题为Caspase-8 induces cleavage of gasdermin D to elicit pyroptosis during Yersinia infection的研究。这两篇文章共同发现耶尔森菌Yersinia感染巨噬细胞后,毒力蛋白YopJ通过抑制TAK1(TGFβ-activated kinase)活性活化了RIP1和Caspase-8。Caspase-8可通过切割GSDMD为活性形式引发焦亡。这两篇研究破除了既往对耶尔森菌引起巨噬细胞凋亡的错误认识,并赋予了凋亡Caspase-8参与焦亡过程的新功能。

两篇文章均发现,在野生型Yersinia感染可以诱导细胞死亡,并可伴有Caspase-8及下游其他Caspase的活化,而YopJ缺失的突变株则无此效应。在使用LPS+5z7(TAK1抑制剂)处理模拟野生型Yersinia感染同样可见检测到细胞死亡增加。Rip3-/-Casp8-/-小鼠BMDM对野生型Yersinia感染和LPS+5z7处理呈现不敏感,而Casp1/Casp11-/-小鼠BMDM仍表现为敏感。在感染过程中,免疫印迹实验可看到Caspase-8发生了活化,并且其下游其他凋亡Caspase(Caspase-3/7)和炎症性Caspase(Caspase-1)也发生一定程度活化。Science文在设置感染后时间点,证实Caspase-8活化优先于GSDMD活化,最后才为Caspase-1活化。二文同样观察到野生型Yersinia感染引起巨噬细胞更多呈现焦亡的形态学特征,PNAS文在此处使用时间间隔显微镜摄影,并用PI和Annexin V染色清晰的展示了该型死亡与常规的凋亡和坏死性的差异。
2018年NCCD将焦亡修正为:一种依赖于gasdermin家族蛋白形成质膜膜孔的可调控的细胞死亡(Regulated cell death),经常但并不总因炎症性Caspase的活化而完成(A type of RCD that critically depends on the formation of plasma membrane pores by members of the gasdermin protein family, often (but not always) as a consequence of inflammatory caspase activation.)
实验目的
了解细胞凋亡的原理
掌握离体诱导凋亡的方法
掌握用普通光学显微镜和荧光显微镜观察凋亡细胞的形态学变化
掌握实验论文写作的方法
 细胞凋亡形态的光学显微镜和荧光显微镜检测
细胞凋亡形态的光学显微镜和荧光显微镜检测
利用普通细胞核核染料
利用细胞核荧光染料
利用TdT介导的dUTP缺口末端标记技术
流式细胞仪检测细胞凋亡
常用的凋亡试剂盒除了采用Annexin-V标记之外,还会加一种DNA染料,常用的有PI和7-AAD,由于死亡的细胞膜通透性增高,染料可以进入细胞内和DNA结合,从而可以发荧光,区分出死细胞。
在细胞凋亡早期位于细胞膜内侧的磷脂酰丝氨酸(PS)迁移至细胞膜外测。磷脂结合蛋白V(Annexin V)与PS具有高度的结合力。被标记的Annexin V可以作为探针检测暴露在细胞外侧的磷脂酰丝氨酸。Annexin V标记,同时结合使用PI拒染法(坏死细胞PS亦暴露于细胞膜外测,且对PI染料高度亲和)可以用流式细胞仪进行凋亡细胞双染后的检测。
细胞凋亡的生化特征:
①胞浆内Ca2+浓度升高。
②细胞内活性氧增多。
③质膜通透性增高。
④DNA内切酶被激活,双链DNA在核小体之间切断形成180~200bp的特征性的有序片断。
⑤Ⅱ型谷氨酰胺转移酶和钙蛋白酶(Calpain)活性升高。
细胞凋亡的生化改变
①DNA片断有规律的降解
②细胞凋亡另一生物特征是DNA发生核小体间的断裂,结果产生含有不同数目核小体单位的片断,在进行琼脂糖凝胶电泳时,形成了特征性的梯状条带(DNAladders),其大小为180-200bp的整数倍; 而细胞坏死时,DNA随意断裂为长度不一的片断,琼脂糖凝胶电泳呈“弥散状”(smearladders)条带。
实验设计:
分小组任选材料,设计诱导凋亡条件。
1、 利用离子胁迫(钾、钠、钙)诱导洋葱细胞凋亡
2、 选择氯化钠、氯化钾、氯化钙为诱导剂,设置不同浓度(5,10,15,20M),分别处理洋葱鳞茎内表皮2、4、6、8、10、15、20min,
分别滴加适量普通染料和荧光染料染色,观察细胞凋亡情况,并进行凋亡细胞的形态学描述。
3、 无机盐胁迫诱导鸡血细胞凋亡
以终浓度为5、10、15、20、25M的NH4NO3 分别处理鸡红细胞2、4、6、8、10、15、20min,观察细胞凋亡情况,并进行凋亡细胞的形态学描述。
实验论文基本要求:
根据课程的实验记录,选择一种材料进行细胞凋亡诱导,对实验结果系统的撰写一篇课程论文。论文字数不少于2000字;参考文献不少于12篇;文字流畅,逻辑性强,应用科学语言进行写作,避免口语化描述;对于所涉及的科学概念与术语力求准确、严谨;系统分析实验数据,应用分析软件,对不同诱导方法及浓度等差异性做显著性分析。论文格式按理科学术论文发表格式撰写。