组织学伴随着显微镜的发明而建立,显微镜的改进升级和标本制备技术的进步推动着组织学和胚胎学的不断发展。光学显微镜的分辨率约为0.2um,可使物体放大几十倍至1000倍,能配察到细胞水平的光镜结构。普通透射电子显微镜的分辨率则提高到0.2nm,放大率为几千倍到几万倍,能观察到亚细胞水平的超微结构。
用光学显微镜与电子显微镜观察标本时,常用的长度计量单位及其之间的换算为:
lmm(毫米)=1000um(微米)
lum(微米)=1000nm(纳米)
Inm(纳米)=1000pm(皮米)
随着技术进步、新方法的不断涌现,必将有力地推动组织学与胚胎学进一步发展。下面就常用的显微镜和样品制备技术作简要介绍。
(一)光学显微镜技术
应用一般光学显微镜(简称光镜)观察组织切片是组织学研究最基本的方法。 通常光镜可放大1000倍左右,分辨率为0.2um。 光镜观察的石蜡包埋组织切片通过取材、固定、石蜡包埋、切片、脱蜡、染色、透明等步骤制成。 组织学中最常用的是苏木精(hematoxylin)和伊红(eosin)染色法,简称HE染色法(图1-1)。 苏木精是碱性染料,能将细胞核染成蓝紫色;伊红是酸性染料,能将细胞质染成红色。对碱性染料亲合力强者,称嗜碱性(basophilia),对酸性染料亲合力强者,称嗜酸性(acidophilia)。若与两种染料的亲合力均不强者,称中性(neutrophilia)。
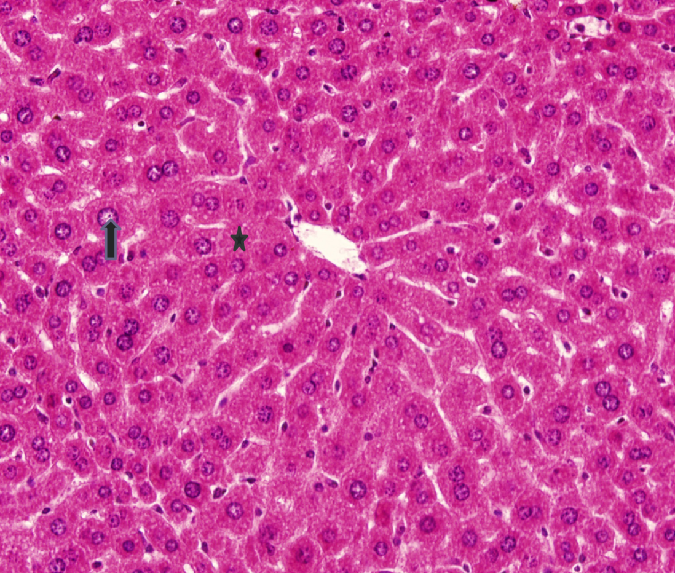
图1-1 肝脏切面光镜像 HE染色(↑细胞核;★细胞质)
此外,还有利用物理吸附作用的染色方法,如用苏丹染料显示脂肪组织,染料溶于脂肪内,使细胞内的脂滴显色。而用硝酸银、氯化金等重金属盐显示细胞和组织的某些结构,则是使金属微粒附着在结构表面而呈棕黑色或棕黄色。银染法中有些组织结构可直接使硝酸银还原而显示,称此为亲银性(argentaffin)(图1-2);有些结构无直接还原作用,需加人还原剂方能显色,则称为嗜银性(argyrophilia)还有些组织成分如结缔组织和软骨基质中的氨基聚糖,当用甲苯胺蓝(toluidine blue)等碱性染料染色后呈紫红色,这种现象称为异染性(图1-3)。
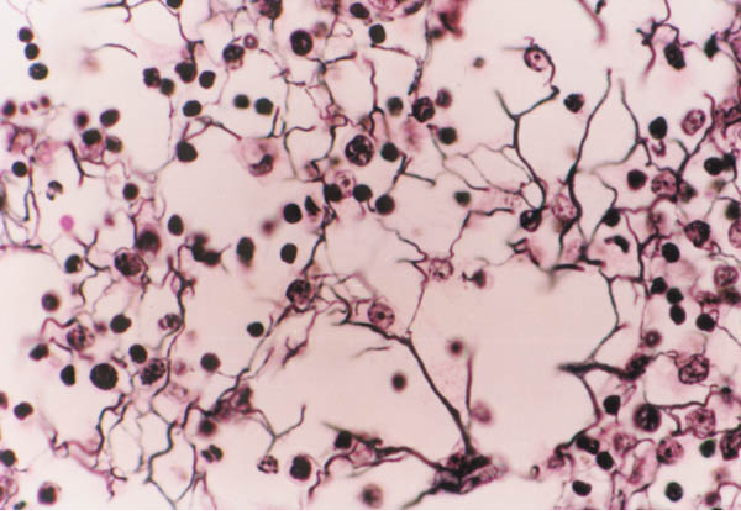
图1-2 淋巴结切面光镜像 镀银染色
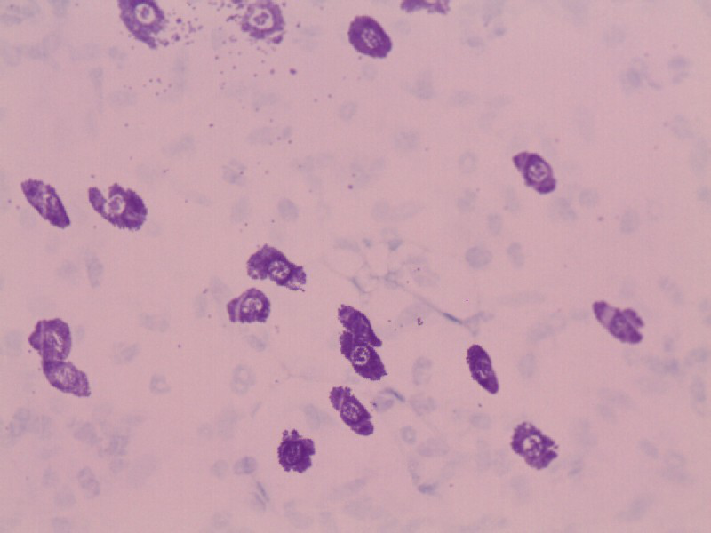
图1-3 肥大细胞光镜像 甲苯胺蓝染色(异染性)
以上方法制备的标本一般是用普通光镜进行观察。
在组织化学术,常使用荧光染料染色或作为标记物,用荧光显微镜(fluorescence microscope)观察(图1-4)。荧光显微镜以紫外线为光源,能激发染料发出荧光。在细胞培养术,一般光镜不易分辨无色透明的活细胞,须用相差显微镜(phase contrast microscope)才能观察。相差显微镜可将活细胞不同厚度及细胞内各种结构对光产生的不同折射,转换为光密度差异(明暗差),从而使镜下结构反差明显,影像清晰(图1-5)。
激光扫描共聚焦显微镜(laser scanning confocal mieroscopy,LSCM)是在荧光显微镜的基础上加装了激光共轭聚焦逐层扫描装置,利用计算机进行图像处理,从而得到细胞或组织内部微细结构的普通光或荧光图像。相对于普通显微镜技术,它可对较厚的组织切片进行连续精确的断层扫描,获得组织内各个层面的精细图像,然后经计算机合成处理后,形成完整的三维图像。它也有利于用激光激发荧光,其激发光强度可精确控制,荧光检测快,对细胞损伤小,具有良好的可重复性。 此技术除可观察固定的组织外,还可动态观察体外培养的活细胞;能对细胞内分子或离子进行标记,检测各种物质的表达及其动态变化;图像数据可及时输出和长期储存。另外,近年出现的双光子显微镜(two-photon microscope)则结合了激光扫描共聚焦显微镜和双光子激发技术,可用于观察更厚的标本,对活细胞的损伤更小,成像的立体感更强。
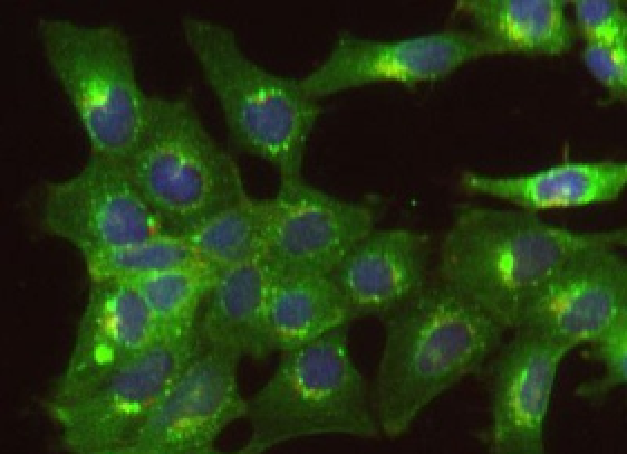
图1-4 成纤维细胞银光染色
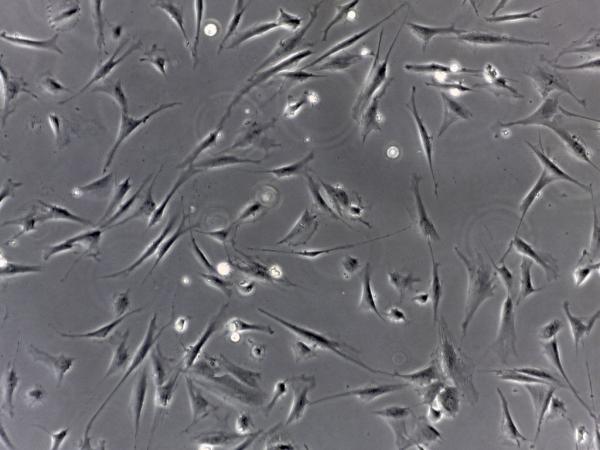
图1-5 相差显微镜观察培养的活细胞
(二)电子显微镜技术
与一般光镜相比,电镜用电子束代替可见光,用电磁透镜代替光学透镜,用荧光屏使肉眼不可见的电子束成像。
1. 透射电镜术(transmission electron microscopy, TEM) 因用电子束穿透样品、产生物像而得名。由于电子易被散射或被样品吸收, 故穿透力低,须制备超薄切片(50~80nm)。取材要尽量新鲜,以保存细胞正常的超微结构。组织块(1mm3以内)用戊二醛与锇酸两次固定, 脱水后树脂包埋,用超薄切片机切片,再经醋酸铀和柠檬酸铅染色。电子束射落到切片时, 随细胞构成成分的密度以及吸附重金属铀、铅、锇的程度不同,而发生相应的电子散射。当电子束投射到密度大、吸附重金属多的结构(如溶酶体)时,电子被散射的多,因此,射落到荧光屏上的电子少而呈暗像,电镜照片上呈黑或深灰色,称该结构为高电子密度(electron-density);反之呈浅灰色,称低电子密度。透射电镜的分辨率可达到0.2nm。
2. 扫描电镜术(scanning electron microscopy, SEM) 取材要求同透射电镜,组织块用戊二醛和锇酸固定后,经脱水、干燥, 再于其表面喷镀薄层金膜。观察时,电镜发射极细的电子束在标本表面扫描,标本表面散射的电子(称二次电子)被探测器收集,形成电信号传送到显像管,在荧光屏上显示标本表面的立体构像。用扫描电镜能观察较大的组织表面, 因其景深长, 凹凸不平的结构也能清晰成像,故图像具有立体感。扫描电镜的分辨率为2nm。
(三)组织化学术
组织化学术(histochemistry)为应用化学、物理、生物化学、免疫学或分子生物学的原理和技术,与组织学技术相结合而产生的技术,能在组织切片定性、定位地显示某种物质的存在与否、以及分布状态。还可进一步用显微分光光度计或图像分析仪测定切片中该物质反应的强度, 获得定量的信息。应用这种技术于游离细胞的样品(如细胞涂片), 则称细胞化学术(cytochemistry)。
1. 一般组织化学术 基本原理是在切片上加某种试剂, 与组织中的待检物质发生化学反应, 其最终产物为有色沉淀物或重金属沉淀, 以便用显微镜观察。如显示糖类, 常用过碘酸希夫反应(periodic acid Schiff reaction,PAS反应)显示聚糖和糖蛋白的糖链。糖被强氧化剂过碘酸氧化后,形成多醛;后者再与无色的品红硫酸复合物(即希夫试剂)结合,形成紫红色反应产物(图1-6)。
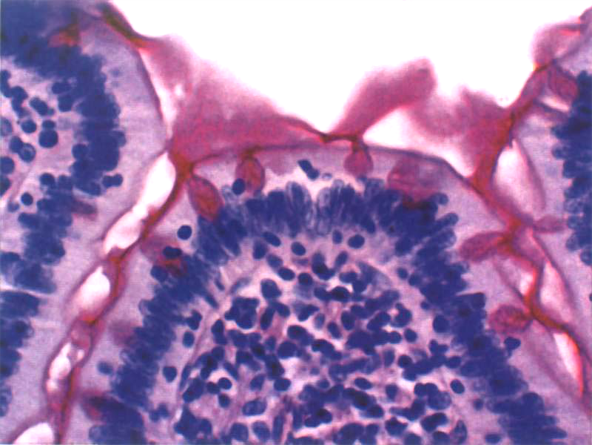
图1-6 小肠光镜像 (PAS反应小肠上皮杯状细胞的黏原颗粒呈红色)
2.免疫组织化学术( immunohistochemistry) 是根据抗原与抗体特异性结合的原理,检测组织中肽和蛋白质的技术。肽和蛋白质均具有抗原性。当把人或动物的某种肽或蛋白质作为抗原注入另种动物,其体内会产生针对该抗原的特异性抗体(免疫球蛋白)。将抗体从动物血清中提出后,与标记物相结合,即成为标记抗体。用后者与组织切片或细胞涂片孵育,抗体则与其中的相应抗原特异性结合,在显微镜下通过观察标记物而获知该肽或蛋白质的分布部位。常用标记物有荧光素和辣根过氧化物酶(图1-7 、 图1-8)。
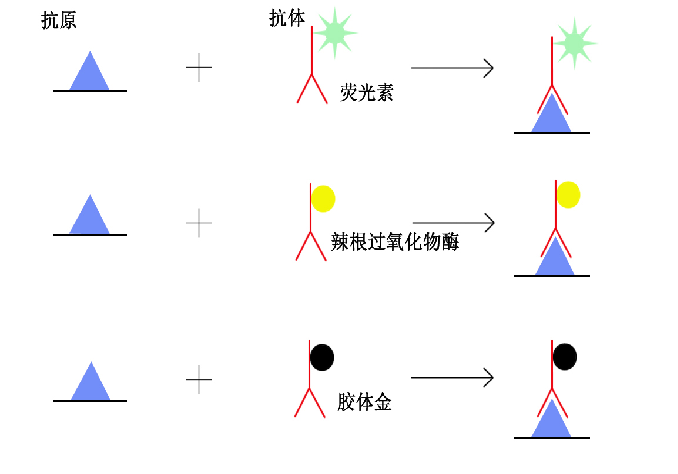
图1-7 免疫组织化学术原理示意图
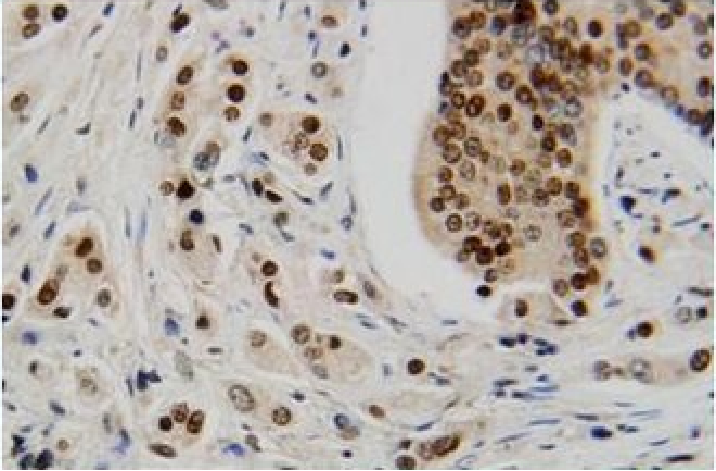
图1-8 免疫组织化学术ABC染色,棕色为阳性反应
3.原位杂交术((in situ hybridization)即核酸分子杂交组织化学术。原位杂交技术的基本原理是利用核酸分子单链之间有互补的碱基序列,将带有标记物的已知碱基序列(即核酸探针)与组织、细胞或染色体上待测DNA片段或RNA,进行特异性原位结合,形成成专一的核酸杂交分子,再经一定的检测手段,对标记物进行显示,从而获知待测核算的有无及相对量(图1-9 )。

图1-9 原位杂交显示大鼠主动脉平滑肌细胞呈弹性蛋白mRNA阳性


