人工染色体载体
人工染色体载体是在人类基因组计划实施过程中构建的一类大容量基因载体,可以满足真核生物基因组文库的构建以及真核基因的克隆、表达等研究,常见的人工染色体载体有酵母人工染色体载体、细菌人工染色体载体和P1人工染色体载体等(表3-2)。
人工染色体载体实际上是一种“穿梭”基因载体,不仅含有质粒载体所必备的第一受体(大肠杆菌)原质粒复制起始位点(ori),而且含有第二受体(如酵母菌)染色体DNA着丝点、端粒和复制起始位点的序列,以及适合的选择标记基因。该类载体在第一受体细胞内可以按质粒复制形式进行高拷贝复制,而在体外与外源DNA复制的形式进行复制和传递。一般采用抗生素抗性选择标记筛选第一受体的克隆子;而利用与受体互补的营养缺陷型筛选第二受体的克隆子。人工染色体载体的显著特点是外源DNA片段的容纳能力大幅增加,一般为数百kb,甚至可达3000kb以上。
人工染色体的必须组成包括复制起始位点(replication origin)、着丝粒(centromere,CEN)和端粒(telomere)。复制起始位点保证了染色体复制;着丝粒保证了染色体分离;端粒封闭了染色体末端,防止粘附到其他断裂端,保证了染色体的稳定存在。
1.酵母人工染色体载体
酵母人工染色体(YAC)载体是最早构建成功的人工染色体,可插入100~2000kb的外源DNA片段。YAC的构建策略为:将酵母染色体DNA的端粒(TEL)、DNA复制起点(ARS)和着丝粒(CEN)以及必要的选择标记基因序列克隆到pBR322中,构建YAC克隆载体。该载体的sup4(酪氨酸+RNA赭石突变抑制)基因上,组装了外源DNA片段的克隆位点。选择标记采用营养缺陷型基因,如色氨酸、亮氨酸和组氨酸合成缺陷型基因(trp1、leu2、his3)尿嘧啶合成缺陷型基因(uta3)以及赭石突变抑制基因(sup4)。与 YAC 载体配套工作的宿主酵母菌(如AB1380)的胸腺嘧啶合成基因带有一个赭石突变ade2-1。带有这个突变的酵母菌在基本培养基上形成红色菌落,当带有赭石突变抑制基因sup4的载体存在于细胞中时,可抑制ade2-1基因的突变效应,形成正常的白色菌落。利用这一菌落颜色转变的现象,可用于筛选载体中含有外源DNA片段插入的重组子。
常用的YAC载体有3种:pYAC3、pYAC4和pYAC5,主要区别是sup4基因上的克隆位点不同,分别为SnaB1、EcoRI和NorI位点。载体pYAC4的构建过程如图3-4所示。
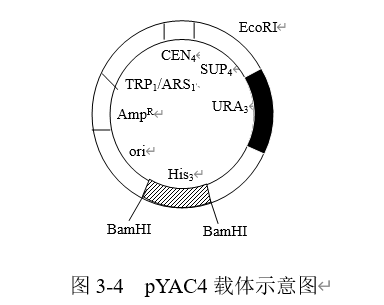
使用pYAC4时,首先用EcoRI和BamHI双酶切割,获得均具BamHI和EcoRI切割末端的两个DNA片段(双臂),随后将两端具EcoRI切割末端的外源DNA与此双臂连接,构成酵母人工染色体。利用电激仪法经酵母人工染色体转化制酵母受体细胞中,在培养基上呈现红色的菌落为阳性克隆子。
YAC是目前较理想的额、具有大容量的克隆载体,但是YAC克隆子的稳定系数较差,操作难度大,极大地制约了以YAC为基础的基因克隆和功能研究。YAC载体的主要局限性为:(1)存在嵌合现象(chimeridm),即一个YAC克隆子中的插入序列可能来自两个或多个不同的片段。研究表明,嵌合体的比例可以达到10%~50%,这使得染色体步移和基因分离的难度增大;(2)YAC克隆子的稳定性差,在几代培养时插入片段可能出行重排和丢失等现象。这对染色体物理图谱的构建和基因分离十分不利;(3)插入片段的分离和纯化等操作难度大,难以维持其完整性;(4)重组子的转化效率低。
2. 细菌人工染色体载体
细菌人工染色体(Bacterial artificial chromosomes,BAC)载体构建的基础是大肠杆菌F因子。研究表明,F因子在大肠杆菌中的复制受到严格控制且保持低拷贝,一般为每细胞1或2个拷贝,具有稳定遗传的特点,机无缺失、重组和嵌合现象发生,减小了克隆片段发生重组的概率。此外,F因子能够携带1MB的外源片段,这为构建大容量克隆能力的BAC 载体称为可能。
BAC载体构建的过程为:BAC空载时长度为7.5kb的环状DNA,携带1个Cmr。BAC的复制单元来自大肠杆菌F质粒,包括严谨型复制子oriS、1个促进DNA复制的由ATP驱动的解旋酶(RepE)以及3个确保低拷贝质粒精确分配至子代细胞的基因座(parA、parB和parC)。BAC载体可通过α互补的原理筛选含有插入片段的重组子,设计了用于回收克隆的Not I酶切的Sp6和T7启动子。重组子通过Not I消化后,可以得到完整的插入片段。
大多数BAC载体的容纳能力为100~350kb,容量比YAC载体小,但也具有YAC载体无可比拟的优点。其优点为:(1)以大肠杆菌为寄主,转化率高,构建BAC文库比YAC文库更易;(2)BAC载体以环型超螺旋状态存在,从大肠杆菌中提取质粒较方便,而从酵母中分离DNA较困难;(3)BAC的复制子来源于F因子,可稳定遗传,缺失、嵌合及重组现象少。(4)可以通过菌落原位杂交来筛选目的基因,方便快捷;(5)BAC载体在克隆位点的两侧具有T7和Sp6聚合酶启动子,可以用于转录获得RNA探针或直接用于插入片段的末端测序。
基于上述优越性,BAC载体成为大片段基因组文库的主要载体也是基因组测序和基因组遗传图谱和物理图谱构建的主要工具。
3. P1人工染色体载体
P1人工染色体(PAC)载体是在P1噬菌体载体的基础上构建的,其克隆容纳量可达300kb,较P1噬菌体载体大,PAC载体具有BAC载体的一些特征。例如,插入的外源DNA没有明显的嵌合和缺失现象、能稳定遗传及高效扩增等。但是,PAC载体自身片段较大(约16kb),构建文库时没有BAC载体效率高。
4.哺乳动物人工染色体
哺乳动物人工染色体(Mammalian artificial chromosome;MAC)是一种大容量载体,MAC构建的理论基础在于将哺乳动物染色体的复制起始序列、端粒和着丝粒分离出来,然后和一些载体元件组合,由此构成的人工染色体可以用作载体将外源基因及其调控序列引入哺乳动物。例如,Ikeno等于1998年将端粒序列及选择标记引入到一种YAC载体,成功构建了MAC载体,结构分析显示MAC并没有获得宿主基因组序列,而且在细胞内复制后可以准确地分离。
应用领域包括:(1)有丝分裂和减数分裂对DNA片段大小的定量分析;(2)研究哺乳动物细胞中染色体功能;(3)对复杂的基因做功能分析;(4)用于体细胞基因治疗。
5. 人类人工染色体
人类人工染色体 (Humanartificial chromosome,HAC)是YAC 理念和技术在高等真核生物中的发展和创新。1997 年Harringotn 等利用来源于人类17号染色体的卫星DNA 体外连接构建成了长约1 Mb的人工着丝粒,并将其和端粒序列以及部分基因组DNA 相连构建了第一个人类人工染色体, 将其转化到人类癌细胞中发现转化出的微小染色体能够在有丝分裂中稳定的存在。目前有4 种不同的HAC 构建策略,包括从头合成组装法(bottom up),端粒介导的截短法(top-down),天然微小染色体改造法和从头染色体诱导合成法。目前科学家利用端粒介导截短法和从头染色体诱导合成法成功构建了HAC,然后通过同源重组等方法向HAC中插入各种用途的基因序列,现已经用于基因治疗和医疗蛋白的生产。然而, 由于很低的转染效率和纯化技术,严重阻碍了HAC在临床上的应用。
6. 植物人工染色体
植物人工染色体 (Plant artificial chromosome,PAC)与HAC 相比,PAC的研究起步较晚,仅在玉米、水稻和拟南芥中有相关的报道。如:Preuss 等(2000,2007)以拟南芥着丝粒DNA 为基础,构建各种组合的微小染色体来确定具有着丝粒功能的最小区域;另外还有研究者采用包含着丝粒区域的YAC 克隆与含有端粒序列和ARS 的YAC 克隆进行同源重组,从而筛选有功能的水稻人工染色体。但上述这些“组装法”的尝试没有成功,可能是植物着丝粒受表观遗传调控失活所致。但在2013年4月发表在《the plant journal》的一篇报道为植物人工染色体的研究带来了新的希望,该研究对拟南芥通过操控细胞内原有的染色体,并进行改编,制作出了比通常染色体要小的环状人工染色体,更重要的是该人工染色体可以遗传给下一代。研究人员还表示,利用这种技术可以只在水稻生长期间,植入抗病虫和抗倒伏等的基因。


