-
1
-
2 习题
一、金属的晶体结构
㈠ 纯金属的晶体结构
由于金属键没有方向性和饱和性,因此大多数金属晶体都具有排列紧密、对称性高的简单结构。在纯金属中,最常见最典型的晶体结构有面心立方结构、体心立方结构和密排六方结构。前两者属于立方晶系,后者属于六方晶系。
1、体心立方晶格
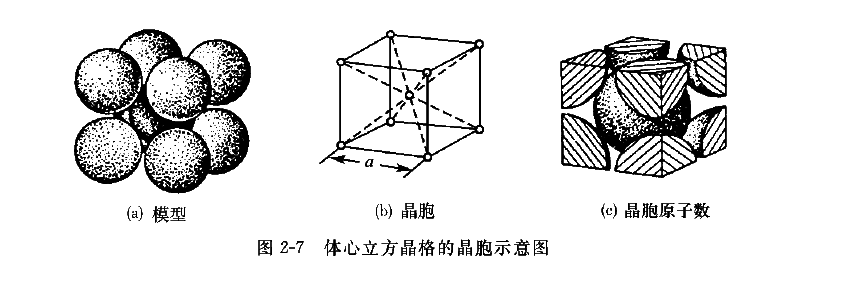
体心立方晶格的晶胞如图2-7所示,为一个立方体。在立方体的八个顶角上各有一个与相邻晶胞共有的原子,立方体中心还有一个原子。晶格常数,因此只用一个参数
表示即可。原子半径为体对角线(原子排列最密的方向)上原子间距的一半,即
。由于立方体顶角上的原子为八个晶胞所共有,而立方体中心的原子为该晶胞所独有,因而晶胞原子数为
。体心立方晶胞中的任一原子(以立方体中心的原子为例)与八个原子接触且距离相等,因而体心立方晶格的配位数为8。其致密度
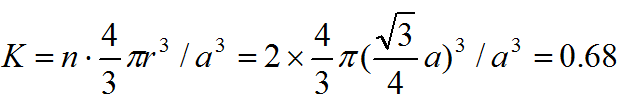
式中,n为晶胞原子数,r为原子半径,为晶格常数。具有体心立方结构的金属有a-Fe、Cr、W、Mo、V、Nb、Ta等。
2、面心立方晶格
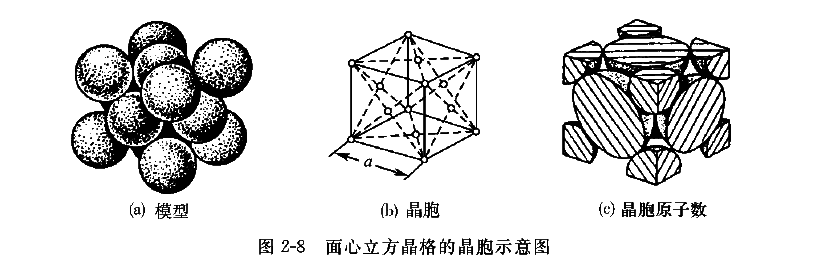
面心立方晶格的晶胞如图2-8所示,也是一个立方体。除在立方体的八个顶角上各有一个与相邻晶胞共有的原子外,在六个面的中心也各有一个共有的原子。与体心立方晶格一样,晶格常数也是只用一个参数表示。原子半径为面的对角线(原子排列最密的方向)上原子间距的一半,即
。由于立方体顶角上的原子为八个晶胞所共有,面上的原子为两个晶胞所共有,因而晶胞原子数为
。面心立方晶格中每一个原子(以面的中心原子为例)在三维方向上各与四个原子接触且距离相等,因而配位数为12。其致密度
。具有面心立方结构的金属有g-Fe、Ni、Al、Cu、Pb、Au、Ag等。
3、密排六方晶格
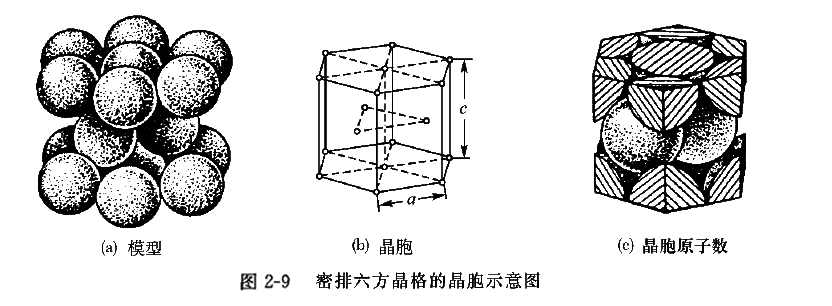
密排六方晶格的晶胞如图2 -9所示,是一个正六棱柱体。在六棱柱的十二个顶角及上下底面的中心各有一个与相邻晶胞共有的原子,两底面之间还有三个原子。晶格常数用六棱柱底面的边长和高c表示,
。原子半径为底面边长的一半, 即
。由于六棱柱顶角原子为六个晶胞共有,底面中心的原子为两个晶胞共有,两底面之间的三个原子为晶胞所独有,因而晶胞原子数为
。密排六方晶格中每一个原子(以底面中心的原子为例)与十二个原子(同底面上周围有六个,上下各三个)接触且距离相等,因而配位数为12。其致密度与面心立方晶格相同,也是0.74。具有密排六方结构的金属有Mg、Zn、Be、Cd等。
㈡ 实际金属的晶体结构
实际金属的晶体结构不像理想晶体那样规则和完整,由于各种因素的作用,晶体中不可避免地存在着许多不完整的部位,这些晶格不完整的部位称为晶体缺陷。晶体缺陷对金属的性能有着重要影响。根据几何特征,可将晶体缺陷分为点缺陷,线缺陷和面缺陷三种类型。
1、点缺陷
点缺陷是指空间三维尺寸都很小的缺陷,如空位、间隙原子、置换原子等(见图2-10)。
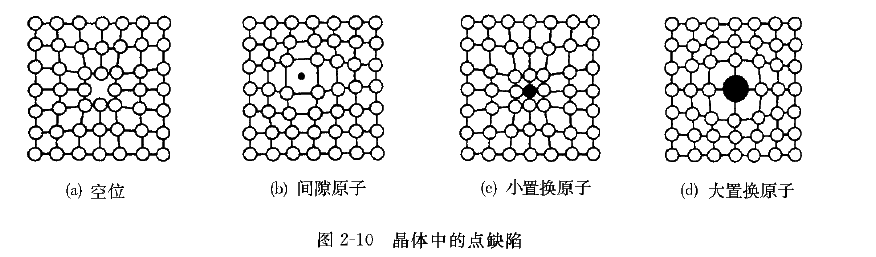
空位是指晶格中某些缺排原子的空结点,空位的产生是由于某些能量高的原子通过热振动离开引起的。某些挤进晶格间隙中的原子称为间隙原子,间隙原子可以是基体金属原子,也可以是外来原子。如果外来原子取代了原来结点上原子的位置,这种原子称为置换原子。
点缺陷的存在,破坏了原子的平衡状态,使晶格发生扭曲(称为晶格畸变),从而引起性能变化,使金属的电阻率增加,强度、硬度提高,塑性、韧性下降。
点缺陷的存在,破坏了原子的平衡状态,使晶格发生扭曲(称为晶格畸变),从而引起性能变化,使金属的电阻率增加,强度、硬度提高,塑性、韧性下降。
2、线缺陷
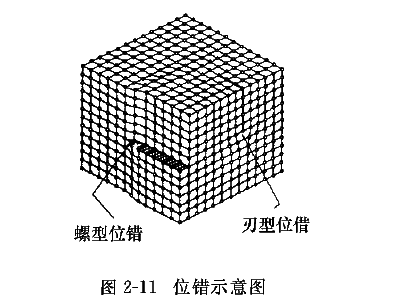 线缺陷就是晶体中的位错。当晶格中一部分晶体相对于另一部分晶体沿某一晶面发生局部滑移时,滑移面上滑移区与未滑移区的交界线称为位错。常见的有刃型位错和螺型位错两种, 如图2-11所示。这里主要介绍刃型位错。
线缺陷就是晶体中的位错。当晶格中一部分晶体相对于另一部分晶体沿某一晶面发生局部滑移时,滑移面上滑移区与未滑移区的交界线称为位错。常见的有刃型位错和螺型位错两种, 如图2-11所示。这里主要介绍刃型位错。
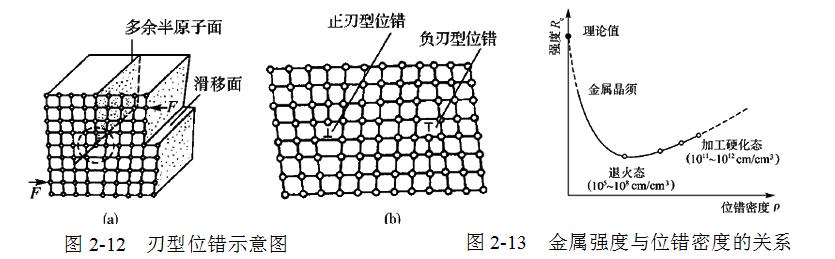
假设在一个完整晶体的上半部插入一多余的半原子面,它终止于晶体内部,好像切入的刀刃一样,这个多余半原子面的刃边就是刃型位错, 如图2-12所示。多余半原子面在滑移面上方的称为正刃型位错,用符号“丄”表示,多余半原子面在滑移面下方的称为负刃型位错,用符号“丅”表示。单位体积内所包含的位错线总长度称为位错密度,即
(式中,
为位错线总长度,
为体积),单位为
或
。
金属的塑性变形主要是由位错运动引起的。因此,阻碍位错运动是强化金属的主要途径。图2-13为金属强度与位错密度的关系曲线,可以看出,减少或增加位错密度都可以提高金属的强度。
3、面缺陷
晶体中一维尺寸很小,另两维尺寸很大的缺陷称为面缺陷,主要包括晶界和亚晶界。
⑴ 晶界
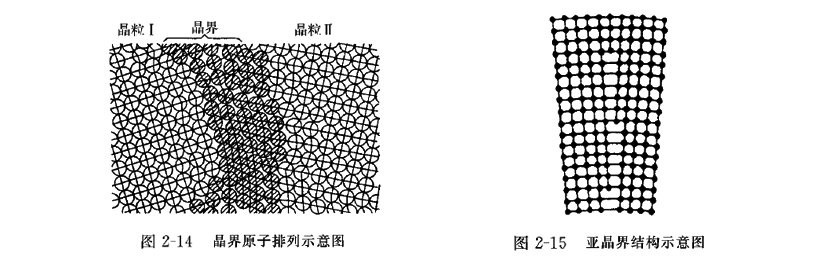
如果一块晶体内部的晶格方位完全一致,这种晶体称为单晶体。实际使用的金属材料几乎都是多晶体,即由许多彼此方位不同、外形不规则的小晶体组成,这些小晶体称为晶粒。晶粒与晶粒之间的交界面称为晶界,如图2-14所示。
晶界的宽度约为5~10个原子间距,晶界两侧晶粒的位向差一般为20~40°。晶界是两个晶粒的过渡部位,原子排列不规则。晶界对运动位错有阻碍作用,是金属中的强化部位。金属的晶粒越细,晶界总面积就越大,金属的强度也越高,因而实际使用的金属材料力求获得细晶粒。晶界的能量比晶内高,因而晶界熔点低、耐蚀性差、原子扩散快。晶界的缺陷比晶内多,因而外来原子易在晶界上偏聚,其浓度高于晶内,称为内吸附。晶界还是固态相变的优先形核部位。
⑵ 亚晶界
晶粒本身也不是完整的理想晶体,它是由许多尺寸很小、位向差也很小(小于1°~2°)的小晶块嵌镶而成,这些小晶块称为亚晶粒。亚晶粒之间的交界面称为亚晶界。亚晶界实际上是由刃型位错垂直排列形成的位错壁,如图2-15。亚晶界对金属同样有强化作用。
㈢ 合金的晶体结构
合金是指由两种或两种以上元素组成的具有金属特性的物质。组成合金的元素可以全部是金属元素,如黄铜(由铜和锌组成),也可以是金属元素与非金属元素,如碳钢(由铁和碳组成)。纯金属获得困难、品种少、力学性能低,因而工业上使用的金属材料多数是合金。
金属或合金中,凡成分相同、结构相同,并与其他部分有界面分开的均匀组成部分称为相。金属材料可以是单相的,也可以由多相组成。通常所说的显微组织实质上是指在显微镜下观察到的各相晶粒的形态、数量、大小和分布的组合。组合不同,材料的性能也不相同。
根据结构特点不同,可将合金中的相分为固溶体和金属化合物两类。
1、固溶体
合金中其晶体结构与组成元素之一的晶体结构相同的固相称为固溶体,习惯上用希腊字母a、b、g……来表示。一般把与合金晶体结构相同的元素称为溶剂,其他元素称为溶质。固溶体是合金中的重要组成相,实际使用的金属材料多数是单相固溶体合金或以固溶体为基的合金。根据溶质原子在溶剂晶格中所处位置不同,固溶体又分为置换固溶体和间隙固溶体两种。
⑴ 置换固溶体
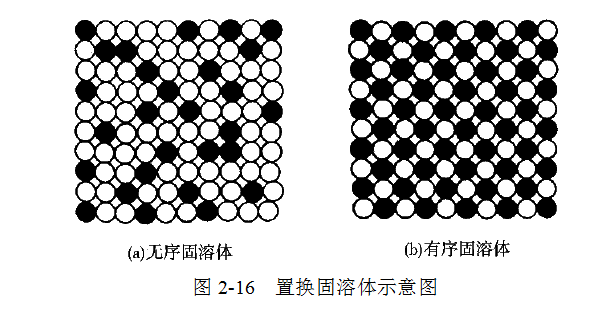
溶质原子占据溶剂晶格某些结点位置而形成的固溶体称为置换固溶体。在置换固溶体中,溶质原子呈无序分布的称为无序固溶体(见图2-16(a)),溶质原子呈有序分布的称为有序固溶体(见图2-16(b))。固溶体从无序到有序的过程称为固溶体的有序化,有序化将使固溶体的性能发生很大变化。
⑵ 间隙固溶体
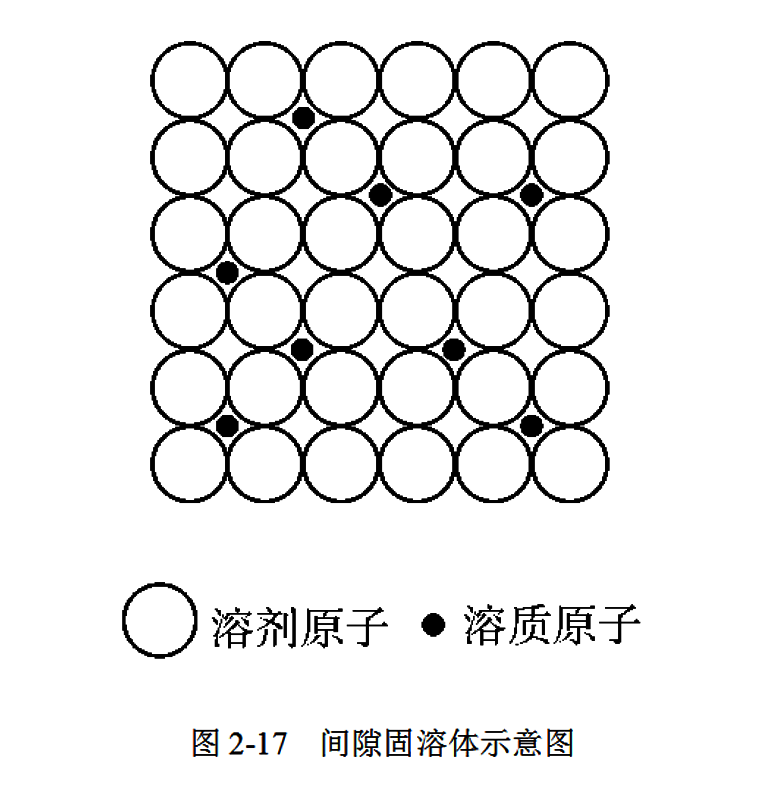 溶质原子嵌入溶剂晶格间隙所形成的固溶体称为间隙固溶体, 如图2-17所示。形成间隙固溶体的溶质元素是原子半径较小的非金属元素,如氢、碳、硼、氮等,而溶剂元素一般为过渡族元素。间隙固溶体都是无序固溶体。
溶质原子嵌入溶剂晶格间隙所形成的固溶体称为间隙固溶体, 如图2-17所示。形成间隙固溶体的溶质元素是原子半径较小的非金属元素,如氢、碳、硼、氮等,而溶剂元素一般为过渡族元素。间隙固溶体都是无序固溶体。
⑶ 固溶体的溶解度
固溶体的溶解度是指溶质原子在固溶体中的极限浓度。根据溶解度不同,固溶体又可分为有限固溶体和无限固溶体。溶解度有一定限度的固溶体称为有限固溶体,而组成元素无限互溶的固溶体称为无限固溶体。组成元素原子半径、电化学特性相近,晶格类型相同的置换固溶体,才有可能形成无限固溶体。而间隙固溶体由于间隙有限,只能形成有限固溶体。
⑷ 固溶体的性能
随溶质含量增加,固溶体的强度、硬度增加,塑性、韧性下降,这种现象称为固溶强化。如铜中加入1%的镍形成单相固溶体后,其由220MPa提高到390MPa,硬度由40HB提高到70HB,y由70%降到50%。产生强化的原因是溶质原子(相当于间隙原子或置换原子)使溶剂晶格发生畸变及对位错的钉扎作用(溶质原子在位错附近偏聚),阻碍了位错的运动。与纯金属相比,固溶体的强度、硬度高,塑性、韧性低。但与金属化合物相比其硬度要低得多,而塑性、韧性要高得多。
2、金属化合物
合金中其晶体结构与组成元素的晶体结构均不相同的固相称为金属化合物。金属化合物具有较高的熔点、硬度和较大的脆性,并可用分子式表示其组成。金属化合物也是合金的重要组成相。当合金中出现金属化合物时,可提高其强度、硬度和耐磨性,但降低塑性。
根据形成条件及结构特点,金属化合物主要有以下几类。
⑴ 正常价化合物
符合正常的原子价规律的化合物称为正常价化合物,通常由金属元素与周期表中IVA族、VA族、VIA族元素组成。如Mg2Si、Mg2Pb、MnS等。
⑵ 电子化合物
符合电子浓度规律的化合物称为电子化合物。电子浓度是指金属化合物中的价电子数目与原子数目的比值。电子化合物多由IB族或过渡族金属与IIB族、ⅢA族、IVA族、VA族元素所组成,其晶体结构与电子浓度值有一定的对应关系,如表2-2所示。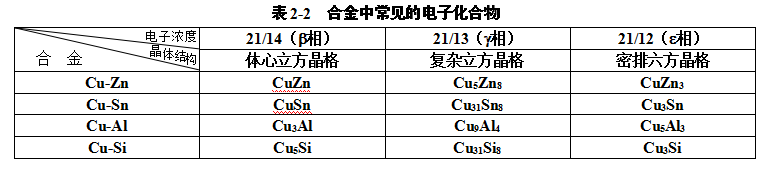
⑶ 间隙化合物
间隙化合物是由过渡族金属元素与碳、氮、氢、硼等原子半径较小的非金属元素形成的化合物。根据结构特点,间隙化合物分为间隙相和具有复杂结构的间隙化合物两种。
① 间隙相
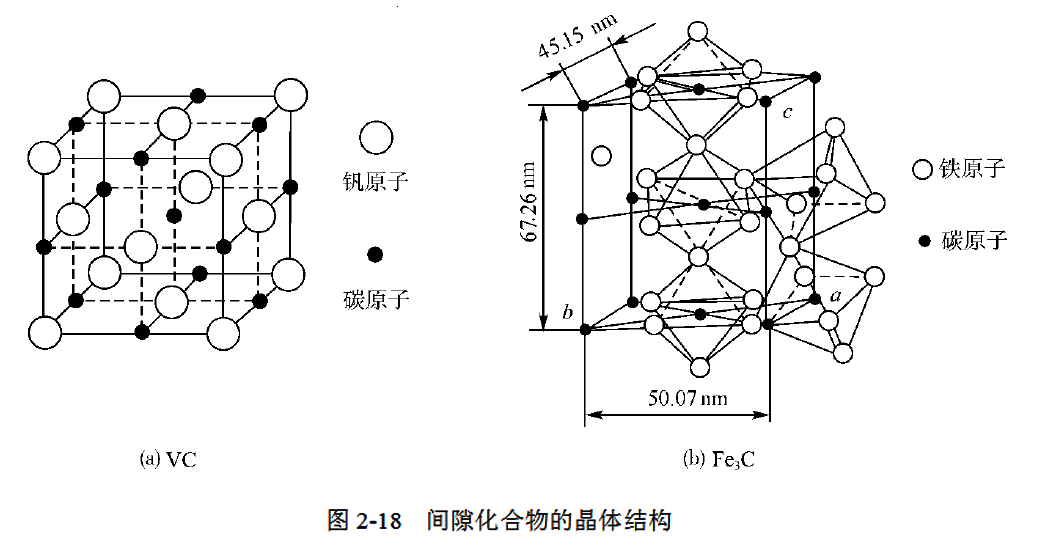
非金属原子半径与金属原子半径的比值小于0.59时所形成的具有简单晶格结构的间隙化合物称为间隙相。部分碳化物和所有氮化物属于间隙相,如表2-3所示。VC的结构见图2-18(a)。间隙相具有金属特征和极高的硬度及熔点,非常稳定。
② 具有复杂结构的间隙化合物
当非金属原子半径与金属原子半径的比值大于0.59时,形成具有复杂结构的间隙化合物。部分碳化物和所有硼化物属于这一类间隙化合物,如Fe3C、Cr23C6、FeB、Fe4W2C等。其中Fe3C称为渗碳体,是碳钢中的重要组成相,具有复杂斜方晶格(见图2-18(b))。
金属化合物也可溶入其他元素原子,形成以化合物为基的固溶体。如渗碳体中溶入Mn、Cr等合金元素所形成(Fe,Mn) 3C、(Fe,Cr) 3C等化合物,称为合金渗碳体。
二、金属的非晶态结构
非晶态金属具有独特的力学性能和物理化学性能,因而对它的研究也越来越受到重视。非晶态金属的结构与液态金属结构相似,原子排列没有长程的周期性。在非晶态金属中,没有晶界、位错等晶态金属所特有的晶体缺陷。
1、非晶态金属结构的描述方法
与晶态相比,非晶态结构是一种无序结构,但不象气体那样原子排列完全没有规则,而存在短程有序。描述非晶态结构目前通用的方法是统计方法,即在非晶态材料中以任一原子为中心,在和它相距为的球壳中发现另一个原子的几率为
。式中,
为径向分布函数;
为单位体积中的原子数;
为双体相关函数。
可见,径向分布函数或双体相关函数可以在一定程度上反映非晶态结构的统计性质,但它给出的仅是有关结构的一维信息,不能给出结构的具体细节。比较气态、非晶态和晶态的双体相关函数可以看出,非晶态结构与液态非常接近,存在一定程度的短程有序,而与气态和晶态则差别显著。
2、非晶态金属的结构模型
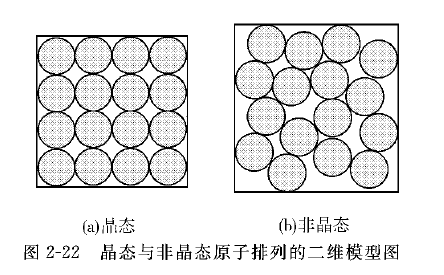 关于非晶态结构细节的研究,多数人共认的模型是硬球无规密堆模型,该模型把原子假设为不可压缩的硬球,均匀、连续、无规地堆积,结构中没有容纳另一硬球的空间,如图2 – 19所示。这种模型的计算结果与实测结果有的符合较好,有的不很相符。
关于非晶态结构细节的研究,多数人共认的模型是硬球无规密堆模型,该模型把原子假设为不可压缩的硬球,均匀、连续、无规地堆积,结构中没有容纳另一硬球的空间,如图2 – 19所示。这种模型的计算结果与实测结果有的符合较好,有的不很相符。


