主要类型有:共价键、离子键、金属键、范德华键(分子键、氢键)
共价键
周期表中同族元素的原子就是通过共价键而形成分子或晶体的,这时满的ns+np壳层是通过两个原子共享它们之间的电子来实现的。典型的例子有H2, O2, F2, SiC, C(金刚石)等。此外,许多碳-氢化合物也是通过共价键结合的。
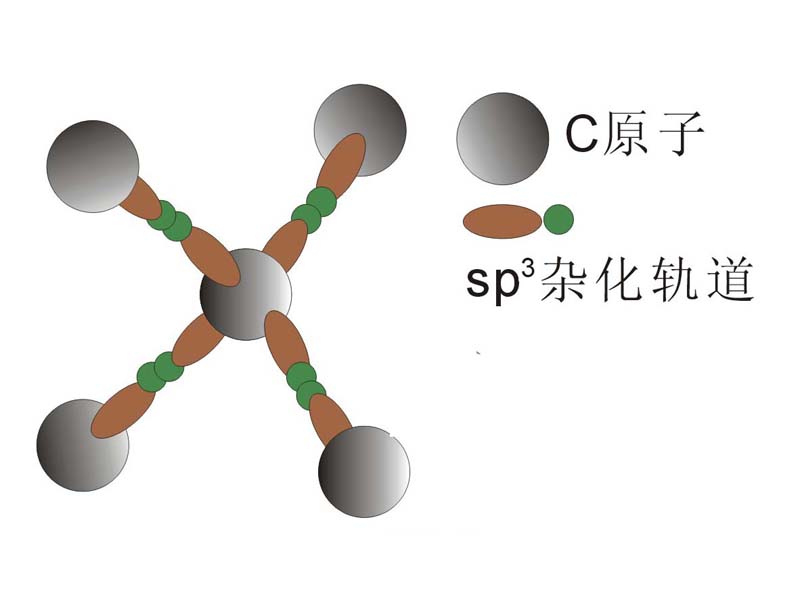
金刚石的共价键示意图
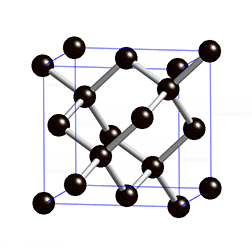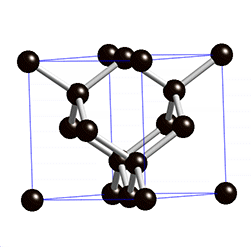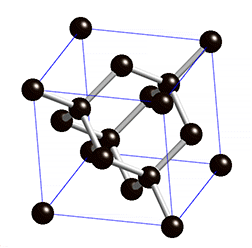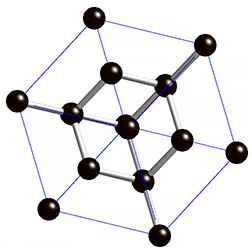
金刚石的晶体结构示意图
共价键中共有电子对不能自由运动,因此共价结合形成的材料一般是绝缘体,其导电能力差。共价键在亚金属(C,Si,Sn等)、聚合物和无机非金属材料中起重要作用。
离子键
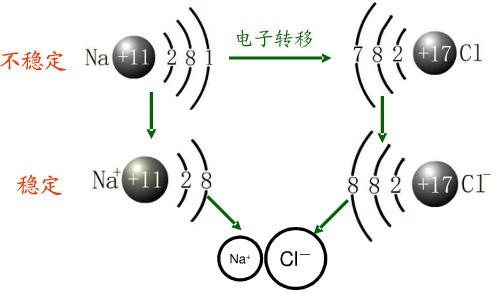
典型的金属元素和非金属元素就是通过离子键而化合的。此时金属原子的外层价电子转移到非金属原子的外层,因而形成外层都是八电子层(满的ns+np支壳层)的金属正离子和非金属负离子。正负离子通过静电引力(库仑引力(Coulombic Forces))而结合成所谓离子型化合物(或离子晶体(Ionic Crystal)),因此,离子键又称极性键。
NaCl离子键示意图
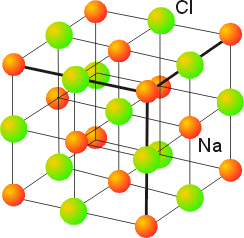
图中所示是离子化合物NaCl离子键示意图。绿色球代表Cl-离子,红色球代表Na+离子。离子键主要依靠它们之间的静电引力结合在一起,因此离子键的特点是:键力较强、结合牢固。因此其熔点和硬度均较高。另外,在离子晶体中很难产生自由运动的电子,因此,它们都是良好的绝缘体。大多数盐类、碱类和金属氧化物主要以离子键的方式结合。
金属原子的外层价电子数比较少(通常s,p价电子数少于4),且各个原子的价电子极易挣脱原子核的束缚而成为自由电子,在整个晶体内运动,即弥漫于金属正离子组成的晶格之中而形成电子云。这种在金属中的自由电子与金属正离子相互作用所构成的键合称为金属键。显然,金属键没有方向性,因而金属原子往往趋于紧密堆垛。

金属键中的金属原子与电子示意图(红色球表示金属原子,绿色球表示电子)

金属晶体中原子的密堆积示意图
分子键
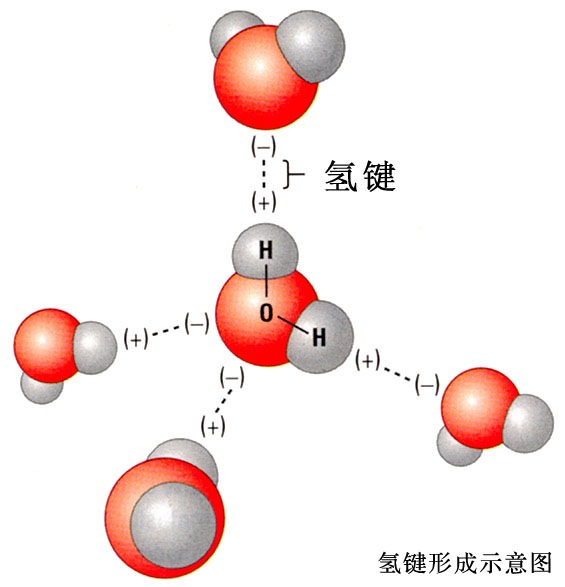
分子键是电中性的分子之间的长程作用力。所有惰性气体原子在低温下就是通过范氏力而结合成晶体的。N2,O2,CO,Cl2,Br2和I2等由共价键结合而成的双原子分子在低温下聚集成所谓分子晶体,此时每个结点上有一个分子,相邻结点上的分子之间就存在着范德瓦尔斯力。正是此种范氏力使分子结合成分子晶体(分子键的名称即由此而来)。 为什么在电中性的原子之间会出现静电引力呢?如果将核外电子的分布(或电子云的密度)看成是不随时间改变的固定分布,那么电中性原子的正电荷中心和负电荷中心在任何时刻都应该重合,因而不可能对其他原子或电子有静电引力。 然而实际上核外电子是在不断运动的(虽然我们不能指出它的运动轨道),因而电子云的密度随时间而变。在每一瞬间,负电荷中心并不和正电荷中心重合,这样就形成瞬时电偶极子(p),产生瞬时电场,如下图所示,在HCl和H2O分子结构示意图中均给出了电偶极子的方向。 范德华键是一种次价键,没有方向性和饱和性,它比化学键的键能小1-2个数量级,远不如化学键牢固。在高分子材料中总的范德华力超过化学键的作用,故在去除所有的范德华力作用前化学键早已断裂了,所以高分子往往没有气态,只有固态和液态。 在HF,H2O,NH3等物质中,分子都是通过极性共价键结合的(见前面关于共价键的讨论),而分子之间则是通过氢键连接的。下面以水为例加以说明。 氢和氧原子间形成共价键。由于氢-氧原子间的共用电子对靠近氧原子而远离氢原子,又由于氢原子除去一个共价电子外就剩下一个没有任何核外电子作屏蔽的原子核(质子),于是这个没有屏蔽的氢原子核就会对相邻水分子中的氧原子外层未共价电子有较强的静电引力(库仑引力),这个引力就是氢键。
类型 作用力来源 键合强弱 形成晶体的特点 离子键 原子得、失电子后形成负、正离子,正负离子间的库仑引力 最强 无方向性键、高配位数、高熔点、高强度、低膨胀系数、塑性较差、固态不导电、熔态离子导电 共价键 相邻原子价电子各处于相反的自旋状态,原子核间的库仑引力 强 有方向性键、低配位数、高熔点、高强度、高硬度、低膨胀系数、塑性较差、即使在熔态也不导电 金属键 自由电子气与正离子实之间的库仑引力 较强 无方向性键、结构密堆、配位数高、塑性较好、有光泽、良好的导热导电性 分子键 原子间瞬时电偶极矩的感应作用 较弱 无方向性键、结构密堆、高熔点、绝缘 氢键 氢原子核与极性分子间的库仑引力 弱 有方向性和饱和性 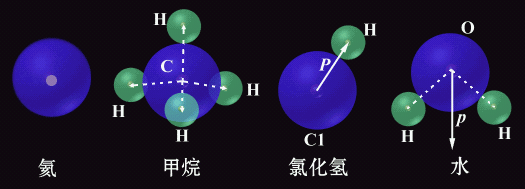
金属材料:主要以金属键结合,个别的有共价(如四价灰锡)和离子键(如金属化合物Mg3Sb2)的特点。具有良好的导电性、导热性和塑性(延展性),并具有金属光泽。




