-
1
-
2
一、蛋白质的两性解离及等电点
1. 蛋白质的等电点(pI):
1.1 定义:
当蛋白质溶液处于某一pH时,蛋白质解离成正、负离子的趋势相等,即成为兼性离子,净电荷为零,此时溶液的pH称为蛋白质的等电点。
1.2 解离式:
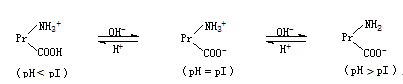
1.3 结论:
pH < pI,Pr解离成阳离子;
pH = pI,Pr为兼性离子;
pH > pI,Pr解离成阴离子。
二、蛋白质的胶体性质
蛋白质是生物大分子,分子量在1万~10万之间,分子直径在胶体颗粒的范围(1~ 100nm),因此具有胶体的性质。
影响蛋白质胶体稳定的因素:颗粒表面电荷、水化膜
例如:加乙醇、丙酮使Pr沉淀——竞争水分子,破坏水化膜
三、蛋白质的紫外吸收性质
由于蛋白质分子中含有共轭双键的酪氨酸和色氨酸,因此在280nm波长处有特征性吸收峰。
四、蛋白质的呈色反应
1. 双缩脲反应(biuret reaction)
蛋白质和多肽分子中肽键在稀碱溶液中与硫酸铜共热,呈现紫色或红色,可用来检测蛋白质水解程度。
2. Folin-酚试剂反应
蛋白质碱性条件下,与酚试剂反应(磷钼酸与磷钨酸的混合物),生成蓝色化合物。
3. 茚三酮反应(ninhydrin reaction)
蛋白质经水解后产生的氨基酸也可发生茚三酮反应,生成蓝紫色化合物。
五、蛋白质的变性、复性
1. 变性:
3.1 定义:
在某些物理或化学因素的作用下,蛋白质特定的空间构象被破坏,从而导致其理化性质改变和生物活性丧失,称为蛋白质的变性。
3.2 变性的本质:
破坏非共价键和二硫键,不改变蛋白质的一级结构
3.3 造成变性的因素:
加热、乙醇等有机溶剂、强酸、强碱、重金属离子及生物碱试剂等
3.4 变性后理化性质的改变:
溶解度降低,粘度增加,结晶能力消失,生物活性丧失,易被蛋白酶水解
3.5 应用举例:
如临床上的消毒、杀菌;保护蛋白制剂(如疫苗)等
2. 复性
若蛋白质变性程度较轻,去除变性因素后,蛋白质仍可恢复或部分恢复其原有的构象和功能,称为复性。
3. 沉淀:
蛋白质自溶液中析出的现象称为沉淀。变性的蛋白质易于沉淀,但不一定都发生沉淀;沉淀的蛋白质易发生变性,但并不都变性,如盐析。
4. 凝固:
加热使蛋白质变性并结成凝块,此凝块不再溶于强酸或强碱中的现象称为蛋白质的凝固作用。凝固是蛋白质变性后进一步发展的不可逆结果。
简单复习本知识点的内容:
1.什么是蛋白质等电点。
2.蛋白质胶体性质的维系因素有哪些?
3.什么是蛋白质变性,变性的本质,变性后哪些理化因素发生改变?
4.蛋白质变性与沉淀有什么关系。


