*酶促反应动力学:
研究各种因素对酶促反应速率的影响,并加以定量的阐述。影响因素包括酶浓度、底物浓度、pH、温度、抑制剂、激活剂等。
一、底物浓度对反应速度的影响
1. 研究前提
① 单底物、单产物反应;
② 酶促反应速率一般在规定的反应条件下进行;
③ 反应速率取其初速率(底物的消耗量在5﹪以内);
④ 底物浓度远远大于酶浓度。
2. 其他因素不变,底物浓度对反应速率的影响呈矩形双曲线关系。
① [S]较低时,V与[S]成正比,为一级反应;
② 随着[S]增高,V与[S]不再成正比例加速,为混合级反应;
③ [S]高达极大时,V不再增加,达Vmax,为零级反应。
2.1米—曼式方程式
2.1.1中间产物学说
[S]很低时,活性中心未完全与S结合,[S]增大,[ES]增大,[P]增加,V增大;
[S]达到一定浓度后,活性中心完全被S饱和,[S]增大,[ES]不增加,[P]不增加,V恒定。
2.1.2米曼式方程式
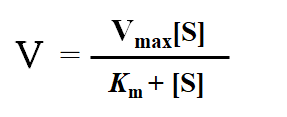
2.2 Km和Vmax的意义
2.2.1米氏常数(Km)的意义
① 当V=1/2Vmax时,可得: Km=[S]
因此,Km值等于酶促反应速率为最大反应速率一半时的底物浓度,单位是mol/L。
② 意义:
a. Km是酶的特征性常数之一,只与酶的结构、底物和反应环境(如pH、温度等)有关,与酶的浓度无关;
b. Km可近似表示酶对底物的亲和力,Km愈小,表示达到最大反应速度时所需的底物浓度愈低,酶与底物的亲和力愈大;反之,亲和力则愈小。
c. 同一酶对于不同底物有不同的Km值,其中Km最小的底物是该酶的天然底物或最适底物。
2.2.2 最大反应速率(Vmax)的意义
Vmax是酶完全被底物饱和时的反应速度,与酶浓度呈正比。
2.3 Km和Vmax值的测定
双倒数作图法(林—贝式作图),1/[S]为横坐标,1/V为纵坐标,纵轴截距为1/Vmax,横轴截距为-1/Km。可直接算出Km与Vmax。
二、酶浓度对反应速度的影响
当[S]>>[E],酶可被底物饱和的情况下,V与[E]成正比。
三、温度对反应速度的影响
1. 双重影响
① T升高,V增大;
② T继续升高,V降低(高温会使蛋白质变性)。
2. 最适温度
V最大时的环境温度。
3. 应用意义
如低温麻醉;疫苗、生物样本的低温保存;高温高压灭菌等。
注:酶的最适温度不是酶的特征性常数;低温使酶的活性降低但并不使酶破坏;高温时酶变性失活。
四、pH对反应速度的影响
1. 酶的最适pH (optimum pH)
酶催化活性最高时反应体系的pH值。
2. 最适pH不是酶的特征性常数。
3. 体内大部分酶最适pH为中性,但少数例外。
五、抑制剂对酶促反应速度的影响
*酶的抑制剂:能使酶的催化活性下降而不引起酶蛋白变性的物质。
*抑制作用的类型(根据抑制剂与酶结合的紧密程度):
不可逆性抑制
可逆性抑制:竞争性抑制、非竞争性抑制、反竞争性抑制。
1. 不可逆性抑制作用
1.1 概念
抑制剂通常以共价键与酶活性中心的必需基团结合,使酶失活;抑制剂不可用透析、超滤等方法去除。
1.2 举例
1.2.1有机磷中毒
抑制羟基酶的活性,可用解磷定(PAM)解毒。
* 具体机制:
有机磷化合物能特异地与胆碱酯酶活性中心丝氨酸残基的羟基结合,使酶失活,造成乙酰胆碱在体内积蓄,出现胆碱能神经过度兴奋而出现一系列中毒症状。
解磷定的-OH更易与有机磷结合,使胆碱酯酶游离而恢复活性。
1.2.2 重金属离子及砷中毒:
抑制巯基酶的活性,可用二巯基丙醇(BAL)解毒。
* 具体机制:
重金属离子能与酶分子的巯基共价结合,使酶失活。
二巯基丙醇分子中含有2个巯基,更易与毒剂结合,使巯基酶的活性恢复而进行解毒。
2. 可逆性抑制作用
抑制剂通常以非共价键与酶或酶-底物复合物可逆性结合,使酶的活性降低或丧失;抑制剂可用透析、超滤等方法除去。
1.1 竞争性抑制作用
1.1.1概念
抑制剂与底物的结构相似,能与底物竞争酶的活性中心,从而阻碍酶底物复合物的形成,使酶的活性降低。
1.1.2特点
① I与S结构类似,竞争酶的活性中心;
② 抑制程度取决于抑制剂与酶的相对亲和力及底物浓度;
③ 动力学特点:Vmax不变,Km增大。
1.1.3举例
如:磺胺类药物
* 磺胺类药物抑菌机制:
某些细菌生长繁殖时,在菌体内FH2合成酶的催化下,利用对氨基苯甲酸(PABA)等物质合成FH2。磺胺类药物与对氨基苯甲酸的结构相似,是FH2合成酶的竞争性抑制剂,可抑制FH2的合成,进而使FH4生成减少,核酸的合成受阻,细菌的生长繁殖受到抑制。人类能直接利用叶酸,故核酸的合成不受磺胺类药物的干扰。
1.2 非竞争性抑制作用
1.2.1概念
抑制剂不与底物竞争酶的活性中心,而是与活性中心以外的必需基团相结合,使酶的构象改变而失去活性。1.2.2特点
① 动力学特点:Vmax降低,Km不变
② I不影响E与S结合,因此Km不变;ESI不能解离产生P和E,所以Vmax降低。
1.2.3举例
一氧化碳中毒、氰化物中毒
1.3 反竞争性抑制
1.3.1概念
抑制剂只能与酶-底物复合物(ES)结合,使ES不能分解成产物。
1.3.2特点
① 抑制剂只与酶-底物复合物结合;
② 抑制程度取决与抑制剂的浓度及底物的浓度;
③ 动力学特点:Vmax降低,Km降低。
六、激活剂对反应速度的影响
使酶由无活性变为有活性或使酶活性增加的物质称为激活剂,如金属离子和小分子化合物。包括必需激活剂和非必需激活剂两种。


